corrosion généralisée
Temps de lecture :Si les produits de la réaction de corrosion sont solubles et si le matériau corrodé est de composition uniforme, la corrosion sera uniforme sur toute la surface. Ce type d’attaque est connu sous le nom de « corrosion généralisée ». En voici quelques exemples.
corrosion acide
Il y a corrosion acide lorsque la concentration en H+ du milieu aqueux est suffisamment faible pour permettre la réduction cathodique de l’eau en hydrogène. La corrosion acide est habituellement « généralisée » dans la mesure où les produits de corrosion sont suffisamment solubles dans le milieu acide pour qu’il n’y ait pas dépôt d’oxyde métallique. Dans le cas de la corrosion acide, la réaction cathodique produit de l’hydrogène moléculaire qui diffusant dans le métal peut entraîner sa fragilisation et des bris observés à haute température ou en présence de pH très acide (décapage…).
corrosion alcaline
La corrosion alcaline résulte de la nature amphotère de certains métaux. Par exemple, l’hydroxyde d’aluminium précipite et forme une couche inhibitrice suivant la réaction :

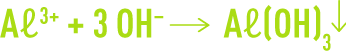
Cependant, à pH élevé, l’hydroxyde d’aluminium peut se resolubiliser suivant la réaction :


Dans des solutions fortement alcalines, cette resolubilisation a pour résultat une corrosion alcaline. L’aluminium et le zinc sont particulièrement sensibles à ce type de corrosion, et même le fer dans les chaudières :
- soit suite à un pH trop élevé dans les eaux en circulation ;
- soit à une surchauffe localisée et à la surconcentration associée en ions OH– dans l’eau.
corrosion complexante
Les complexants sont des agents chimiques formant des complexes solubles et stables avec les ions métalliques. Ils sont utilisés dans les chaudières ou autres applications pour empêcher d’éventuels dépôts ou dissoudre les dépôts existants. La plupart d’entre eux réagissent sur les couches passives, et peuvent donc provoquer ou contribuer à la corrosion du métal de base.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












