influence du pH en eau aérée
Temps de lecture :La solubilité du Fe2+ diminue considérablement lorsque le pH augmente et il en résulte la formation d’un film isolant d’hydroxyde ferreux (et d’autres oxydes déjà cités) ; ceci se traduit par un accroissement prépondérant des surfaces cathodiques et la réduction des plages anodiques à des éléments de surface ponctuels. La densité du courant électrique de corrosion est d’autant plus forte sur ces plages anodiques que leur surface est plus faible.
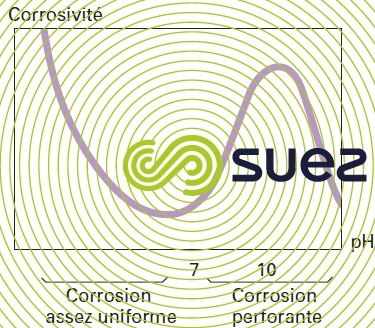
Le risque de corrosion par piqûres en présence d’oxygène est d’autant plus fort que le pH s’approche de 10 ; au-delà, le processus de corrosion diminue ; il s’arrête à pH 10,5 pour la plupart des eaux (figure 10). C’est ainsi que de nombreuses corrosions localisées ont été rencontrées en présence d’eaux décarbonatées dont le pH était compris entre 9 et 10 et dont l’alcalinité n’était plus suffisante pour maintenir le film de Tillmans (voir passivation de l'acier au carbone par les eaux naturelles).


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












