cultures libres (boues activées) (page 2)
élimination de l’azote
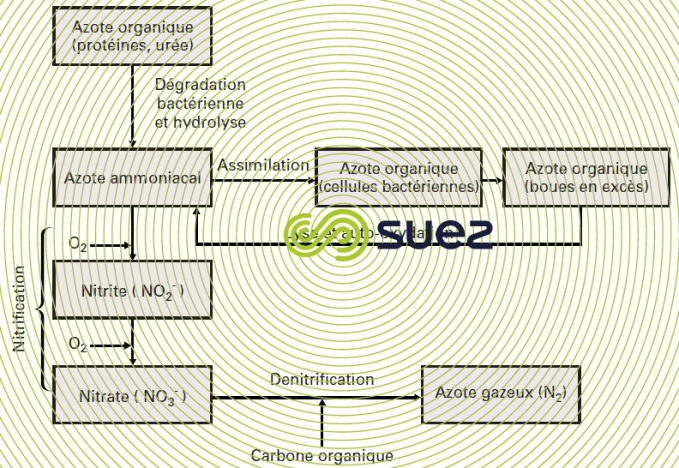
Dans les ERU ainsi que dans de nombreuses ERI, l’azote est essentiellement présent sous forme organique et ammoniacale. Dans une station conçue pour éliminer l’azote, cette élimination est classiquement jusqu’alors la résultante de quatre opérations (figure 12). D’autres voies sont en cours de développement :
- l’ammonification : transformation de l’azote organique en azote ammoniacal ;
- l’assimilation : utilisation de l’ammoniaque pour synthétiser de la matière vivante qui sera éliminée avec les boues en excès ;
- la nitrification : oxydation de l’azote ammoniacal en nitrites puis nitrates ;
- la dénitrification : transformation des nitrates en azote gazeux dégagé à l’atmosphère


l’ammonification
C’est la transformation de l’azote organique en azote ammoniacal. La vitesse d’ammonification est identique à la vitesse de dégradation des pollutions carbonées.
Dans la grande majorité des cas, compte tenu de la nature de l’azote organique et des paramètres de fonctionnement des stations et plus particulièrement du temps de séjour de l’eau dans les ouvrages, la plus grande partie de l’azote organique sera ammonifiée sans problème.
l’assimilation
C’est l’utilisation d’une partie de l’azote ammoniacal pour la synthèse bactérienne. L’assimilation peut jouer un rôle prépondérant pour l’élimination de l’azote dans certaines
ERI lorsque le rapport

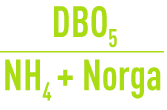
est élevé. En première approximation, on peut considérer que l’azote éliminé par les boues en excès représente de 5 à 10 % de ces dernières.
la nitrification
La nitrification est un procédé biologique réalisé par des micro-organismes autotrophes spécialisés en deux étapes :
- oxydation de NH4+ en nitrites NO2-; c’est l’œuvre essentiellement des bactéries du type Nitrosomonas selon la réaction :


- oxydation de NO2-en nitrates NO3- ; les bactéries responsables de cette deuxième réaction appartiennent principalement au genre Nitrobacter

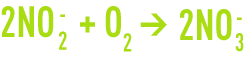
d’où la réaction d’oxydation totale


Sur la base de ces réactions, l’oxygène requis pour l’oxydation complète de l’azote ammoniacal est de 4,57 g O2 · g–1 N-NH4 oxydé (hors azote utilisé pour la synthèse).
La quantité d’alcalinité nécessaire à la réaction peut être estimée par l’équation :


Soit 7,14 g d’alcalinité (exprimés en CaCO3) ou encore 0,714 °F par g N-NH4 oxydé. Par ailleurs, environ 0,17 g de cellules nouvelles sont produites par g N-NH4.
taux de croissance et âge de boue
Le taux de croissance des bactéries Nitrosomonas et Nitrobacter est faible comparé à celui des organismes hétérotrophes. Il constitue habituellement le paramètre le plus contraignant pour le dimensionnement du réacteur de nitrification. Plus précisément l’étape limitante est l’oxydation de l’ammonium en nitrites, liée à l’activité principalement de Nitrosomonas (en-dehors de situations transitoires particulières, telles que la mise en route de l’installation). Du fait de ce faible taux de croissance, le volume du réacteur biologique d’une installation visant à l’élimination de l’azote est très souvent déterminé par l’âge de boue aéré. En effet, il faut que la quantité de bactéries nitrifiantes apparues dans le système soit supérieure ou égale à celles perdues dans la boue en excès extraite sinon un « lessivage » est observé.
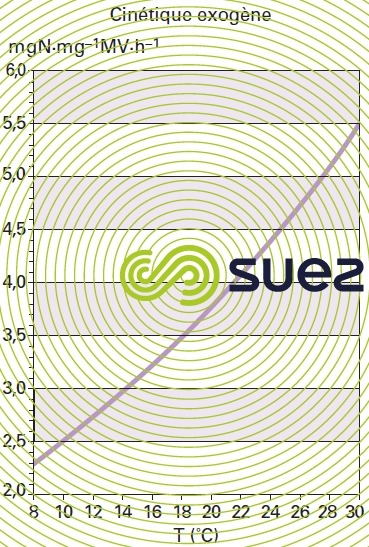
Ce dernier est très dépendant de la température. Dans des conditions de pH comprises entre 7,2 et 8, l’âge de boue aérée minimal pour maintenir une nitrification stable est lié à la température par la courbe de la figure 13.

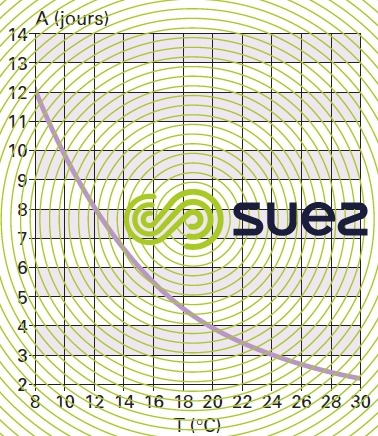

Cette courbe montre qu’à la température de 12 °C, souvent utilisée pour le dimensionnement, la nitrification oblige à considérer des âges de boues supérieurs à 8 jours qui conduisent à l’adoption de procédés à faible charge. En dessous de 8 °C le démarrage de la nitrification est extrêmement aléatoire. En revanche, si la faune nitrifiante a pu être préalablement développée à une température normale, le processus de nitrification peut être maintenu à des températures inférieures avec des rendements d’oxydation du N-NH4 diminués, le lessivage des nitrificateurs n’étant que progressif. De la même manière, une nitrification peut se maintenir même avec un âge de boue inférieur à la valeur minimale, à condition que ce mode de fonctionnement soit de durée limitée (événement pluvieux par exemple).
Dans certaines applications (influent avec rapport C/N faible), il faudra vérifier que le volume de réacteur aéré déterminé par l’âge de boue est compatible avec la cinétique de nitrification maximale (à la température considérée).
facteurs influençant la nitrification
La nitrification est affectée par un certain nombre de facteurs environnementaux parmi lesquels le pH, la concentration en oxygène dissous, la présence d’éléments inhibiteurs ou toxiques :
- pH et alcalinité : la nitrification est sensible au pH. Elle est optimale pour une fourchette de pH variant de 7,2 à 8,0 et diminue de manière significative pour un pH inférieur à 6,8. La réaction consomme de l’alcalinité et dans certaines régions avec des eaux douces, de l’alcalinité doit être ajoutée à l’eau usée de manière à maintenir un pH acceptable (plus particulièrement lorsque la nitrification est combinée à une précipitation simultanée du phosphore). Les réactifs utilisés à cet effet peuvent être la chaux, la soude ou le carbonate de soude ;
- oxygène dissous : la cinétique de nitrification est influencée par la concentration en oxygène dissous de la liqueur mixte. Elle augmente jusqu’à des concentrations de 3 à 4 mg · L–1, elle est fortement inhibée pour des concentrations inférieures à 0,5 mg · L–1. La valeur de consigne recommandée en exploitation se situe autour de 1,5 à 2 mg · L–1 d’O2 dissous. Toutefois, pour une même valeur de consigne, des cinétiques de nitrification différentes peuvent être observées d’un site à l’autre car l’effet de l’oxygène dissous dépend de la taille du floc biologique et de la demande totale en oxygène de la liqueur mixte. En effet, l’oxygène de la phase liquide diffuse au sein du floc et les bactéries les plus éloignées de la périphérie sont exposées à des concentrations de plus en plus faibles ;
- éléments inhibiteurs et toxiques : les organismes nitrifiants sont sensibles à de nombreux composés organiques ou minéraux, à des concentrations bien inférieures à celles qui affectent des organismes aérobies hétérotrophes.
- Les principaux toxiques minéraux (cuivre, zinc, nickel, chrome hexavalent, cadmium, mercure) seront inhibiteurs à partir de concentrations de quelques mg/l et variables selon les composés. Les bactéries seront aussi sensibles aux variations de concentrations de ces éléments .Une acclimatation à, des concentrations de 10 à 20 mg/l pourra s’établir sur une longues durée pour certains de ces métaux
- La salinité et surtout les variations de salinité auront aussi un effet inhibiteur pour la nitrification.
- Pour les composés organiques, il faut distinguer les composés organiques biodégradables (phénol par exemple) qui seront toxiques en cas d’accumulation dans le réacteur ou lors de fortes variations de charge et les composés organiques peu ou pas dégradables qui pourront être inhibiteurs à de très faible concentration, 0,076 mg/l pour la thiourée par exemple.

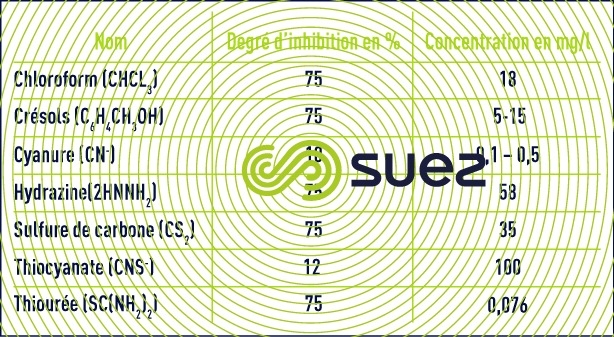


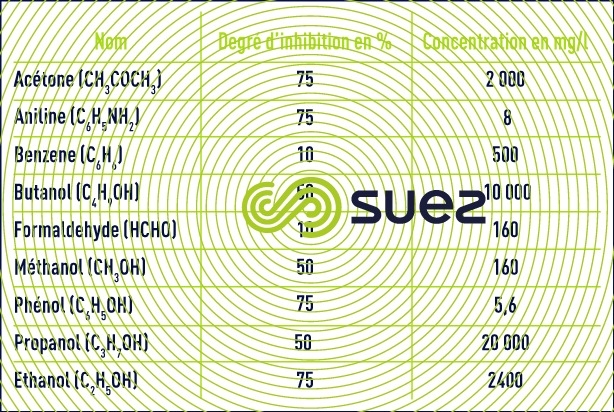

À noter également que la présence de matières organiques biodégradables ralentit l’oxydation de l’ammonium, en raison de la compétition pour l’oxygène dissous avec les organismes hétérotrophes et ceci même en maintenant des concentrations en O2 élevée (3-4 mg · L–1). C’est pour cette raison que plusieurs auteurs ont affirmé que la nitrification supposait une bonne élimination préalable de la pollution carbonée ; en fait, un certain recouvrement est possible, mais les systèmes à forte charge sont exclus.
la dénitrification
La dénitrification est le processus par lequel certaines bactéries réduisent les nitrates en azote gazeux. La dénitrification biologique est une partie intégrante de l’élimination biologique de l’azote, associée à l’étape de nitrification, en vue de respecter la norme de rejet en azote total. En fait deux modes de réduction des nitrates peuvent intervenir dans les systèmes biologiques ; la voie assimilative et la voie dissimilative, cette dernière pouvant être réalisée par des bactéries autotrophes ou hétérotrophes.
Le mode le plus couramment mis en œuvre est la voie dissimilative avec utilisation de bactéries hétérotrophes. La réduction des nitrates se produit à travers différentes réactions, que l’on peut schématiser ainsi :


C’est un procédé anoxie (qui a lieu en absence d’oxygène mais en présence de forme oxydée de l’azote) et nécessite un donneur d’électron. Le donneur d’électron sera de préférence la DCO biodégradable de l’eau brute, en l’absence de celle-ci, la matière organique de la biomasse (respiration endogène de la boue), ou une source de carbone exogène telle que le méthanol ou un acétate.
À l’inverse de la nitrification, la réaction de dénitrification hétérotrophe fournit de l’alcalinité, qui représente 3,57 g (exprimés en CaCO3) par g N-NO3 réduit.
taux de croissance
En dénitrification biologique, les équations cinétiques utilisées pour décrire la croissance bactérienne et l’utilisation du substrat sont similaires à celles décrites pour les bactéries aérobies hétérotrophes. La principale différence vient du fait que le nitrate sert d’accepteur d’électron au lieu de l’oxygène.
L’influence de la température sur la vitesse de dénitrification est similaire à celle utilisée pour la dégradation de la DBO en milieu aérobie (figure 14).
Certains paramètres sont néanmoins spécifiques à la dénitrification ; l’oxygène dissous, la source de carbone organique et dans une moindre mesure, le pH.


facteurs influençant la dénitrification
- pH et alcalinité : du fait que de l’alcalinité est produite lors des réactions de dénitrification, le pH reste généralement élevé. La fourchette de pH optimale se situe entre 7 et 8,2 ;
- oxygène dissous : la présence d’oxygène dissous inhibe la dénitrification. En effet les bactéries dénitrifiantes tirent leur énergie de celle libérée lors du transfert des électrons des composés organiques vers O2, NO2- ou NO3-. Si ces trois éléments sont disponibles comme accepteur d’électron, le choix de l’accepteur final est bien entendu celui qui fournit la plus grande quantité d’énergie par unité de matière organique oxydée. Cette énergie étant plus grande dans le cas de l’oxygène que dans les autres, il en résulte que les électrons sont transférés en priorité sur l’oxygène (plus de dénitrification). En pratique, il est difficile de donner des concentrations limites en O2 au-delà desquelles la dénitrification est inhibée, car ces valeurs dépendent de la taille du floc, de la nature et de la concentration en carbone organique. Cependant, des concentrations en O2 dissous supérieures à 0,3 mg · L–1 sont déjà inhibitrices. Une autre approche consiste à mesurer non pas l’O2 dissous, mais le potentiel d’oxydoréduction par rapport à l’électrode à l’hydrogène (EH). Bien que les chiffres rencontrés divergent, on peut estimer que la dénitrification ne s’effectue dans des conditions acceptables que si le potentiel d’oxydoréduction est inférieur à 200 mV ;
- source de substrat carboné : le substrat carboné influence fortement la cinétique de dénitrification par sa nature et sa concentration. Le carbone rapidement biodégradable contenu dans l’eau brute va permettre une vitesse élevée de dénitrification a contrario du carbone lentement biodégradable. Dans certains procédés, les sulfures peuvent également servir de substrat à la dénitrification. Une source de carbone exogène, telle que le méthanol ou l’acétate, peut être ajoutée en pré-anoxie ou post-anoxie de manière à fournir la DBO nécessaire à la réduction des nitrates et à accroître fortement la cinétique de dénitrification.
- Charge massique /âge des boues : On notera également qu’une augmentation de la charge massique du réacteur biologique a un effet positif sur la vitesse de dénitrification. Cet effet est habituellement peu utilisé du fait que les installations de nitrification/dénitrification sont limitées à un fonctionnement à faible charge pour assurer la nitrification. Toutefois, certains procédés ou schémas particuliers (cultures mixtes, cultures « maillées ») sont capables de tirer profit de cet avantage.
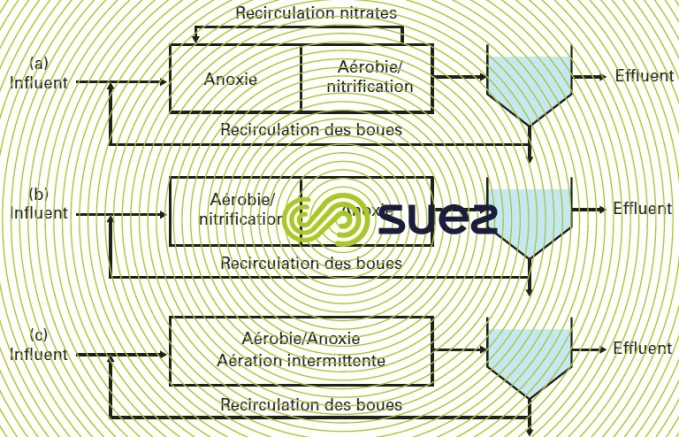
Différents schémas de base sont utilisés pour réaliser la dénitrification conduisant à des cinétiques variables.
Le premier schéma consiste en un bassin anoxie suivi d’un bassin d’aération où a lieu la nitrification (figure 15 (a), schéma connu sous le nom de Modified Ludzack-Ettinger ou d’« anoxie en tête »). Les nitrates produits dans le bassin d’aération sont recyclés dans le bassin anoxie. Le substrat organique de l’eau brute fournit le donneur d’électron pour les réactions d’oxydoréduction utilisant les nitrates. La réaction de dénitrification est dite « dénitrification préanoxie ». Elle est rapide mais limitée par la quantité de NO3- apportée par la recirculation.
Dans le second schéma (figure 15 (b)), la dénitrification a lieu après la nitrification et la source de donneur d’électron provient uniquement de la respiration endogène. La réaction de dénitrification est dite « dénitrification endogène », la cinétique correspondante est nettement inférieure à la précédente puisque la DBO de l’influent a été consommée et n’est plus disponible comme source d’énergie. Notons que cette mise en œuvre n’est pas utilisée pour le traitement des effluents résiduaires urbains.
Le troisième schéma (figure 15 (c)) consiste à ménager des périodes aérées pour la nitrification et des périodes anoxies pour la dénitrification dans le même réacteur, en pratiquant une aération séquencée et un brassage mécanique continu. La dénitrification est dite « dénitrification mixte » et la valeur de la cinétique obtenue est intermédiaire avec les deux précédentes.


D’autres mises en œuvre sont envisageables notamment le procédé trizone. Dans cette configuration, une zone dite « endogène »est ajoutée en aval de la zone anoxique et du bassin d’aération.



Cette configuration présente plusieurs avantages dont :
- obtention de rendements de dénitrification élevés
- réduction du taux de recirculation interne du fait que la liqueur recyclée est à une concentration en nitrates plus élevée que celle de l’eau traitée.
les bactéries anammox
La réaction Anammox (ANaerobic AMMOnium OXidation) découverte au début des années 1990 mais prédite dès les années 1980 offre une alternative au traitement conventionnel de l’azote. Aujourd’hui on considère que ces bactéries sont ubiquitaires et elles sont présentent aussi bien dans les océans ou elles seraient responsables de 30 à 50% de la consommation de l’azote que dans les écosystèmes aquatiques d’eau douce (estuaires, sols,…).
- Lors de cette réaction, en condition anoxie (en absence d’oxygène), l’ammonium est transformé en azote gazeux en utilisant les nitrites comme accepteur d’électron, selon la réaction suivante :


On remarque qu’une fraction de l’azote se retrouve sous forme de nitrate à l’issue de cette réaction.
Le prérequis à cette réaction est la nitrification partielle c’est-à-dire l’oxydation de l’ammonium en nitrites. Ceci correspond à la première étape de la nitrification conventionnelle et elle met en œuvre les bactéries nitrifiantes « classiques ».
La nitrification conventionnelle est assurée en deux étapes :
- L’oxydation de l’ammonium en nitrite, assurée par des bactéries de type Nitrosomonas, AOB (AOB :Ammonium Oxidizying Bacteria)
- L’oxydation des nitrites en nitrates, assurée par des bactéries de type Nitrobacter, NOB (NOB : Nitrite Oxidizying Bacteria)
Tel que représenté ci-dessous, un élément favorisant la nitrification partielle est qu’à température élevée (supérieure à 18 ° C), le taux de croissance des AOB est plus élevé que celui des NOB, ce qui limite le développement de ces dernières.

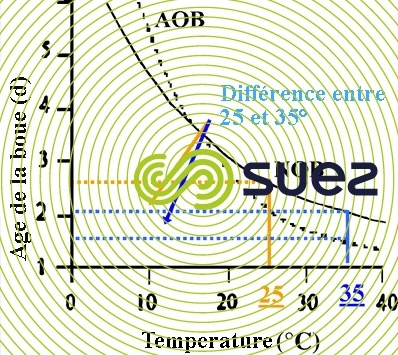

De manière générale ,on considère que la nitrification partielle est favorisée par :
- Une température élevée (supérieure à 22 ° C).
- Une concentration en oxygène résiduelle faible lors de la phase aérée (inférieure à 1 mg/L).
- Un pH compris entre 7 et 8.
La réaction Anammox nécessite :
- La présence des deux substrats (nitrite et ammonium) à un ratio proche de 1,3
- Une concentration en nitrites modérée ; il n’existe pas de valeur seuil admise par tous dans la mesure ou les bactéries ont une grande capacité à s’adapter mais une concentration supérieure à 100 mg/L (en N-NO2) peut être considérée comme valeur limite.
- L’absence d’oxygène résiduel et de carbone biodégradable.
La réaction de Dé-ammonification (nitrification partielle + Anammox) a été maîtrisé au stade industriel à la fin des années 1990 pour le traitement de l’azote des retours centrats de déshydration des boues digérées par voie anaérobie. Cet effluent concentré en azote et dépourvu de carbone biodégradable est bien adapté pour ce type de traitement. La température élevée est également un élément favorable pour la croissance de ces bactéries autotrophes (croissance lente). Les premiers essais et réalisations industrielles ont été réalisés sur ce type d’effluent, ce qui permettait un traitement économique de l’azote, au début des années 2000 .
Le procédé Cleargreen a été développé pour le traitement des centrats de déshydratation des boues digérées par voie anaérobie. Les réactions de nitrification partielle et de dénitrification autotrophe ont lieu dans un réacteur SBR à niveau variable et mettant en œuvre un cycle de traitement spécifique.
L’utilisation des capteurs à membrane sélective permettant une mesure en ligne de la concentration en ammonium (et dans une moindre mesure en nitrate) est un élément important pour le contrôle de ces réacteurs en permettant un ajustement des conditions de la nitrification partielle (en particulier du ration Ammonium/Nitrite).
Le tableau tableau 7 présente une comparaison des besoins des différentes voies de traitement de l’azote :



En conclusion, l’élimination de l’azote par les bactéries Anammox permet une économie de l’ordre de 60 % en apport d’air, ne mobilise pas de carbone biodégradable et génère peu de boue en excès. Maitrisé sur des effluents spécifiques (centrats de déshydratation de boues digérées par voie anaérobie, lixiviats, lisiers, effluents industriels) cette nouvelle voie de traitement de l’azote offre des perspectives nouvelles pour le traitement des eaux résiduaires urbaines : c’est un enjeu des années futures.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












