dioxyde de chlore
Temps de lecture :Le dioxyde de chlore est un composé instable qui doit être préparé en solution sur les lieux de son utilisation. Il s’obtient par oxydation d’une solution de chlorite de sodium, à l’aide de chlore ou d’acide chlorhydrique.
oxydation du chlorite de sodium par le chlore


Stœchiométriquement, pour produire 1 g de CℓO2, il faut 1,34 g de chlorite de sodium et 0,526 g de chlore.
Ce procédé intéresse les installations qui disposent de chlore gazeux utilisé en préoxydation ou en un point quelconque de la ligne de traitement. Le pH de l’eau de chlore doit être compris entre 1,7 et 2,4. Sa concentration peut varier entre 2,5 et 6 g · L–1 Cℓ2.
Dans le cas d’eau à fort TAC, il est nécessaire d’utiliser de l’eau de chlore et sa concentration doit être la plus élevée possible.
L’eau de chlore est mise en contact avec la solution concentrée de NaCℓO2 (solution commerciale à 310 g · L–1) au sein d’une tour de contact garnie d’anneaux Raschig. Le temps de contact au sein de cette tour doit être inférieur à 10 minutes (optimum = 6 min). La solution de dioxyde de chlore est transférée par l’eau motrice d’un hydroéjecteur dans un bac de stockage avant distribution dans l’eau du réseau. Dans ce bac, la solution de CℓO2 est diluée (0,5 à 1 g · L–1) et reste stable plus longtemps (24 heures). Pratiquement, en considérant un excès de chlore de 10 % par rapport à la stoechiométrie et un rendement de 95 %, il faut, pour produire 1 g de CℓO2, 1,41 g de chlorite de sodium pur et 0,61 g de chlore.
action de l’acide chlorhydrique sur le chlorite de sodium
On a la réaction suivante :

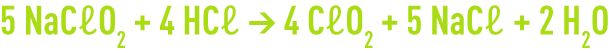
Stœchiométriquement, il faut 1,67 g de NaCℓO2 pour produire 1 g de CℓO2.
Ce procédé de fabrication du CℓO2 est mis en place dans les usines qui ne disposent pas de chlore gazeux ou de possibilité de stockage de chlore gazeux.
La figure 21 présente une installation de CℓO2, qui utilise des réactifs concentrés dilués à l’entrée du réacteur :
- chlorite de sodium en solution à 25 % (310 g · L–1) ;
- acide chlorhydrique en solution à 32 % (370 g · L–1).

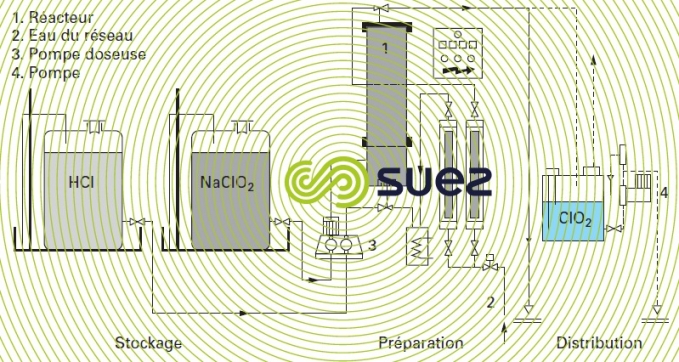

Un volume de chlorite de sodium à 25 % est mélangé à environ 0,65 vol. d’acide chlorhydrique concentré à 32 % et 6 vol. d’eau de dilution primaire pour obtenir une solution de dioxyde de chlore à 17 g · L–1. Un litre de NaCℓO2 à 25 % donne ainsi 125 g de CℓO2. Le temps de réaction optimal est de 6 minutes.
La solution de CℓO2 est reprise par hydroéjecteur et ainsi diluée avant le bac de stockage.
distribution des solutions de dioxyde de chlore
Si elle n’est pas diluée à la sortie du réacteur, la solution concentrée de CℓO2 doit être distribuée immédiatement. En effet, cette solution n’est pas stable et se décompose en CℓO3– et CℓO2–. Les solutions diluées de CℓO2 (concentration en CℓO2 comprise entre 0,5 et 1 g · L–1) peuvent être distribuées pendant 24 heures au maximum.
précautions à prendre pour l’emploi des réactifs
préparation de la solution de chlorite de sodium
Les solutions de chlorite de sodium peuvent être préparées à partir de chlorite de sodium en poudre. Il est nécessaire, pour éviter la précipitation de carbonate de calcium, d’utiliser de l’eau préalablement adoucie.
stockage des solutions
Les solutions concentrées de NaCℓO2 sont sensibles au froid. Pour une solution à 25 % de NaCℓO2 le début de cristallisation se situe vers 10 °C.
Les solutions de chlorite de sodium et d’acide chlorhydrique doivent être stockées dans des locaux chauffés à 15 °C.
manutention
À cause de ses propriétés oxydantes, le chlorite ne doit pas entrer en contact avec les matières réductrices :
- le soufre et ses dérivés ou les produits en contenant ;
- les matières organiques ;
- les métaux en poudre…
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












