élimination du fer
Temps de lecture :états naturels du fer
Dans les eaux de surface, le fer se trouve généralement sous forme ferrique et précipitée, souvent associé aux MES ; il est alors éliminé au cours de la clarification. En revanche, on le rencontre sous forme ferreuse dans les couches profondes de certaines réserves d’eaux eutrophisées privées d’oxygène et dans la plupart des eaux souterraines : ce fer réduit Fe(II) est alors dissous et souvent complexé.
le fer ferreux
Libre, il existe sous forme ionisée : Fe2+ en général, ou plus rarement FeOH+ (pH > 8,3). Dans les eaux dont le TAC est notable, l’ion Fe2+ se rencontre surtout à l’état d’hydrogénocarbonate (ou bicarbonate) et sa solubilité, limitée par la précipitation du carbonate, très peu soluble, suit les relations :

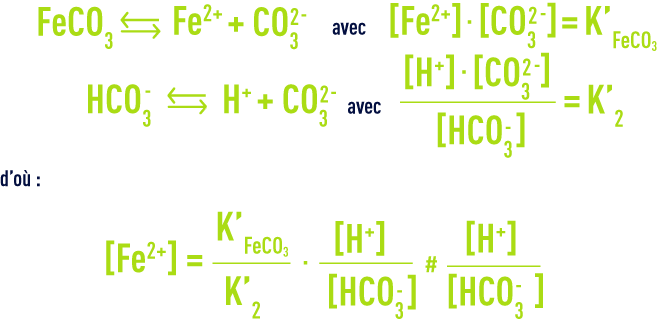
(les valeurs numériques des deux constantes étant très voisines) ; transcrite en unités pratiques, la relation ci-dessus devient :

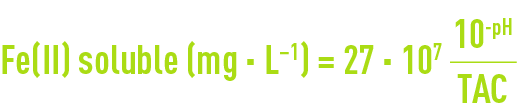
et montre que la solubilité croît lorsque pH et TAC décroissent.
Remarque 1 : si la concentration en fer dissous se maintient au-dessus de cette valeur théorique, au lieu de précipiter l’excédent de Fe2+ sous forme de FeCO3 (sidérite), on doit suspecter la présence de fer complexé, source de difficultés pour le traitement physico-chimique du fer.
Remarque 2 : en présence d’H2S, la solubilité est beaucoup plus faible (à cause de la faible valeur du produit de solubilité du sulfure ferreux qui, de ce fait, précipite).
le fer complexé
Il s’agit de complexes faisant intervenir Fe2+ ou Fe3+ :
- minéraux : silicates, phosphates ou polyphosphates, sulfates, cyanures… ;
- organiques : il s’agit de phénomènes de chélation, en particulier avec les acides humiques, fulviques, tanniques…
Remarque : le fer est souvent associé au manganèse (voir la section élimination du manganèse) et/ou à l’ammonium (voir la section élimination de l'ammonium).
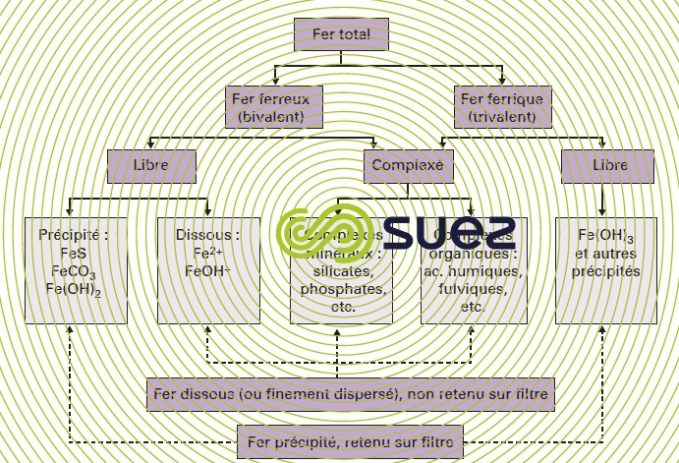
Pour définir un traitement de déferrisation, il ne suffit donc pas de connaître la teneur totale en fer, mais aussi les différentes formes sous lesquelles cet élément est susceptible de se présenter (les différents états du fer dans l’eau sont résumés dans la figure 20), ce qui suppose la connaissance de tous les autres paramètres susceptibles d’interférer sur cette spéciation.
Il est nécessaire de déterminer sur place toutes les caractéristiques instables de l’eau, après avoir procédé à une exploitation suffisante du forage pour être certain de la représentativité de l’échantillon. Il est indispensable de mesurer ainsi : température, pH, potentiel redox, O2 dissous, CO2 libre, fer dissous… et sur place ou au laboratoire, il faut déterminer également la silice dissoute et les MO (les deux causes les plus fréquentes de complexation) ainsi que les paramètres susceptibles de demander un traitement associé ou simultané à celui de la déferrisation (Mn, NH4,H2S, reminéralisation…). Un examen au microscope est également recommandé pour déterminer l’absence ou la présence de bactéries du fer.


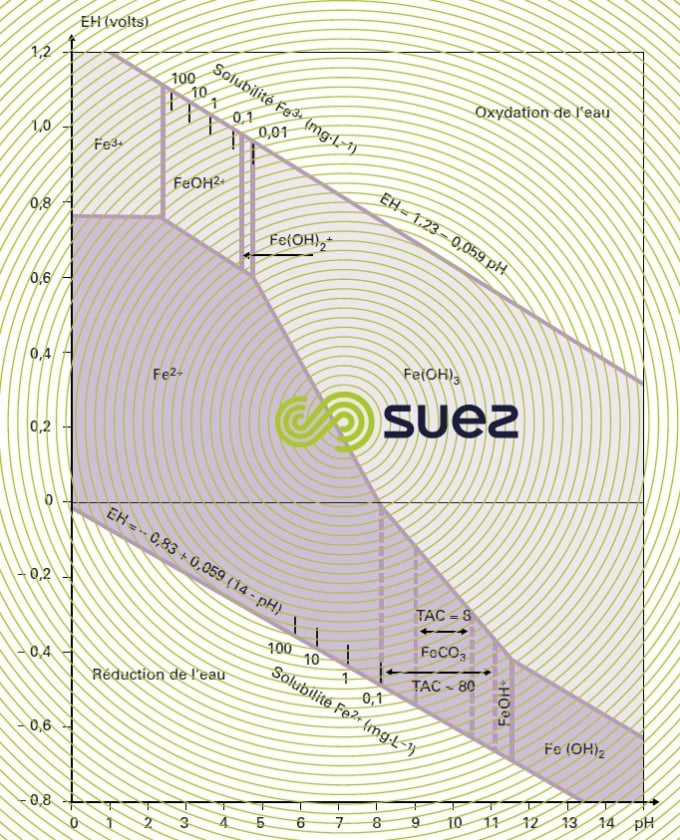
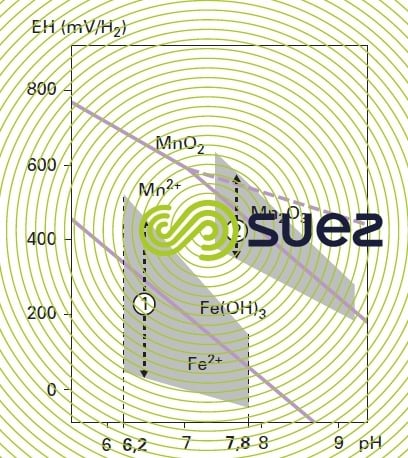
La forme du fer dans l’eau dépend avant tout du pH et du potentiel d’oxydoréduction ; sur la figure 21, on voit qu’il est possible de passer d’une forme dissoute du fer (par exemple Fe2+ ou FeOH+) à une forme précipitée (FeCO3, Fe(OH)2 ou Fe(OH)3) en élevant soit le potentiel (oxydation), soit le pH, soit les deux à la fois. C’est sur ces principes, et plus particulièrement sur la séquence [oxydation Fe2+ – précipitation Fe(OH)3,puis filtration], que sont fondés les différents traitements physico-chimiques envisageables.


déferrisation physico-chimique
Cette technique, avec oxydation à l’air et filtration, a longtemps été la plus utilisée, en particulier sur les eaux de forage. Éventuellement, on peut y ajouter un certain nombre de traitements supplémentaires tels que : correction de pH, oxydation chimique, floculant, clarification… Il est toujours utile d’aérer une eau d’origine profonde dépourvue d’oxygène, même si on utilise également un oxydant chimique (prévention de problèmes en distribution : corrosions, goûts et odeurs…). Cette aération devient encore plus nécessaire si l’eau contient de l’H2S.
L’ozone et le permanganate de potassium sont les meilleurs oxydants de complément, notamment en présence de fer complexé. Au cas où l’eau contient une forte proportion de MO ou de manganèse, il faut déterminer si possible expérimentalement la dose à introduire.
déferrisation simple sans décantation (aération-filtration)
principe
Ce procédé concerne les eaux souterraines dont la teneur maximale en fer est de l’ordre de 7 mg · L–1 et qui ne présentent, par ailleurs, pas d’autres caractéristiques défavorables : manganèse, couleur, turbidité, acides humiques ; une faible teneur en ammonium et une agressivité carbonique modérée peuvent être tolérées.
Le premier stade du traitement de déferrisation est alors fondé sur une oxydation du fer divalent par l’oxygène de l’air. Cette aération (voir la section oxydation par l'air) peut se faire soit à la pression atmosphérique, soit sous la pression de refoulement dans le réseau, évitant dans ce dernier cas un pompage de reprise et tout contact de l’eau avec le milieu extérieur. En revanche, l’aération à la pression atmosphérique permet souvent d’évacuer à moindres frais du gaz carbonique agressif (qui demanderait un traitement coûteux de neutralisation), voire de l’H2S (voir la section élimination de l'h2s).
La rapidité de l’oxydation du fer divalent par l’oxygène dépend de plusieurs facteurs, en particulier : température, pH, teneurs en fer et en oxygène dissous. La réaction peut s’écrire :

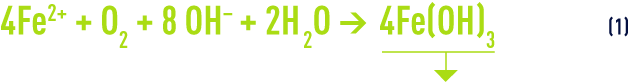
et sa cinétique s’exprime par la relation :

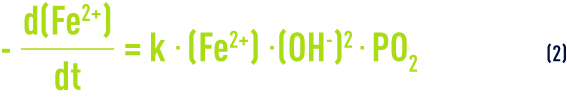
PO2 est la pression partielle d’oxygène et k une constante fonction de la température et du pouvoir tampon de l’eau brute.
L’équation (2) montre que la réaction est d’autant plus rapide que le pH est plus élevé et que l’eau est plus proche de la saturation en oxygène. Le temps d’oxydation déterminé en laboratoire sur une eau synthétique peut se trouver considérablement diminué sur la plupart des installations, grâce à certains effets catalytiques dus principalement aux dépôts antérieurs. Certains phénomènes biologiques, étudiés plus loin, vont dans le même sens. En revanche, la présence d’acides humiques retarde l’oxydation du fer.
Le précipité obtenu est principalement de l’hydroxyde floconneux Fe(OH)3, conformément à l’équation (1). Il peut s’y ajouter, en proportions variables suivant les conditions locales, des oxyhydroxydes nFe2O3 n’H2O dont certains sont de nature cristalline, et parfois du FeCO3 (eaux à fort TAC)… Il en résulte que les conditions de traitement et les performances de la filtration qui fait suite à l’oxydation peuvent être très différentes d’une station à l’autre.
Pour toutes ces raisons, à l’optimum, la taille effective du matériau filtrant peut se trouver comprise entre 0,6 et 1 mm et la vitesse entre 5 et 15 m · h–1. Le poids de fer retenu par unité de surface filtrante est lui aussi très variable : 200 à 1 000 g Fe par m2 de sable, suivant les cas, et jusqu’à 2 000 g · m–2 sur un filtre bicouche (anthracite + sable), option réservée aux cas difficiles. Une teneur initiale en Fe2+ élevée favorise une forte rétention.
Certaines substances, comme les acides humiques, les silicates, les phosphates, les polyphosphates, jouent un rôle inhibiteur dans l’oxydation, la précipitation ou la filtration de l’hydroxyde ferrique. C’est ainsi que la présence de silice conduit à la formation du complexe FeSiO(OH)32+, stable en milieu alcalin (alors que l’élévation du pH est, par ailleurs, nécessaire pour l’oxydation et l’hydrolyse du fer, d’où un compromis à rechercher).
On peut combattre ces effets par des traitements complémentaires : oxydation (permanganate de potassium, ozone), coagulation (sulfate d’alumine) ou floculation (alginate ou polymère agréé) suivant le cas.
mise en œuvre
Le type le plus courant est celui de l’installation sous pression représentée par la figure 22 qui comporte :
- une tour d’oxydation comprenant un lit de pouzzolane qui divise l’eau et lui assure, par contact avec l’air, une grande surface d’oxydation ;
- un filtre lavable par retour d’eau et insufflation d’air.

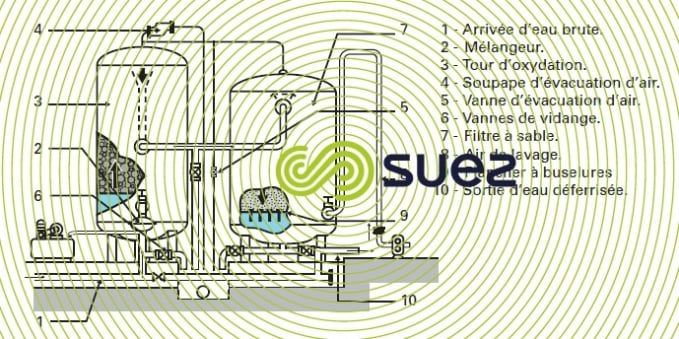

La photo 17 en donne un exemple de réalisation.



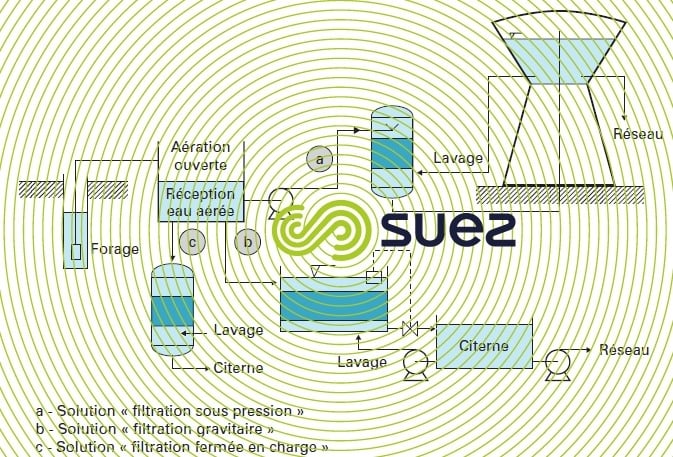
Les stations gravitaires comportent une aération à la pression atmosphérique (cascade, pulvérisation…) suivie d’une filtration ouverte ou fermée (dans ce dernier cas, avec ou sans pompage de reprise). La figure 23 propose trois exemples de réalisation suivant ce principe (le lavage se pratiquant également à l’air et à l’eau).


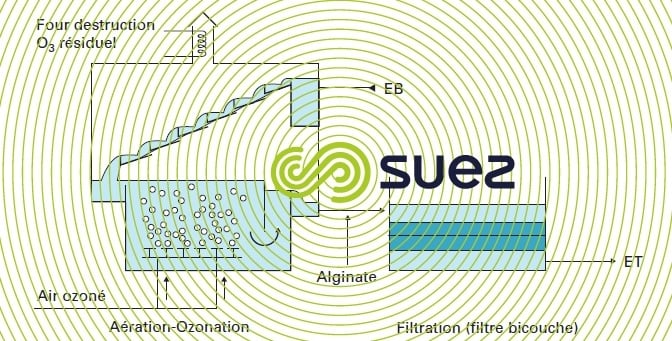
L’oxydation peut également être réalisée par l’ozone, comme dans le cas de l’installation de Crissey qui comporte (figure 24) :
- une aération par cascade. Cette cascade est mise en œuvre au-dessus de la cuve d’ozonation et permet une première oxydation par l’ozone résiduel s’échappant de la cuve d’ozonation ;
- une cuve d’ozonation pour l’oxydation principale du fer ;
- une injection d’alginate pour améliorer les qualités du floc ;
- une filtration sur filtre bicouche ;
- vitesse de filtration : 7 m · h–1 ;
- sable TE = 0,5 mm, H = 0,4 m ;
- hydroanthracite TE = 0,85 mm, H = 0,5 m.


déferrisation avec décantation
Il est nécessaire d’intercaler une décantation entre l’aération et la filtration (voir l’exemple de la filière de Mimizan, figure 25) dans les cas suivants :

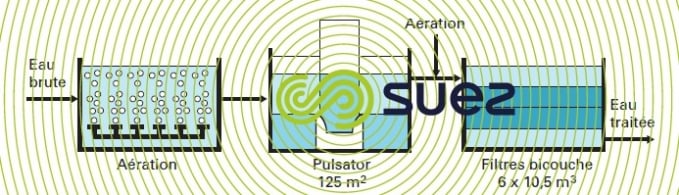

- dose de fer élevée dans l’eau brute, conduisant à un volume de précipité excessif ;
- présence de couleur, de turbidité, d’acides humiques, d’agents complexants…, provoquant une diminution importante de la cinétique d’oxydation et de précipitation du fer, et/ou impliquant l’adjonction d’un coagulant (sulfate d’aluminium ou chlorure ferrique) à une dose supérieure à une dizaine de g · m–3 de produit commercial.
Les procédés de décantation à contact de boues conviennent alors tout particulièrement au traitement de ces eaux. En variante, le floc léger d’hydroxyde ferrique obtenu à partir des eaux souterraines, généralement dépourvues de turbidité, se prête également bien à une séparation par flottation à air dissous.
traitement associé à une décarbonatation
La décarbonatation à la chaux, génératrice d’un pH élevé, est favorable à l’élimination du fer et du manganèse. Ainsi, la précipitation du carbonate ferreux est pratiquement totale à pH 8,2 (surtout lorsqu’elle se produit conjointement avec celle du CaCO3)et celle de l’hydroxyde ferreux l’est à pH 10,5 (figure 26).

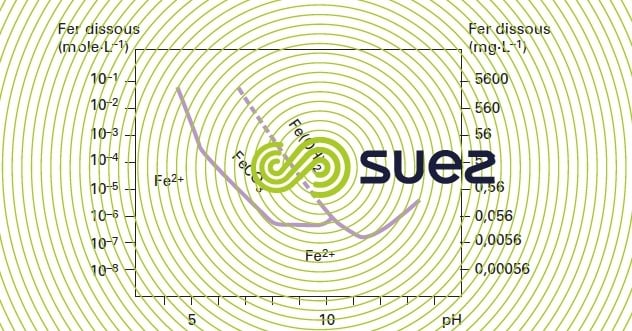

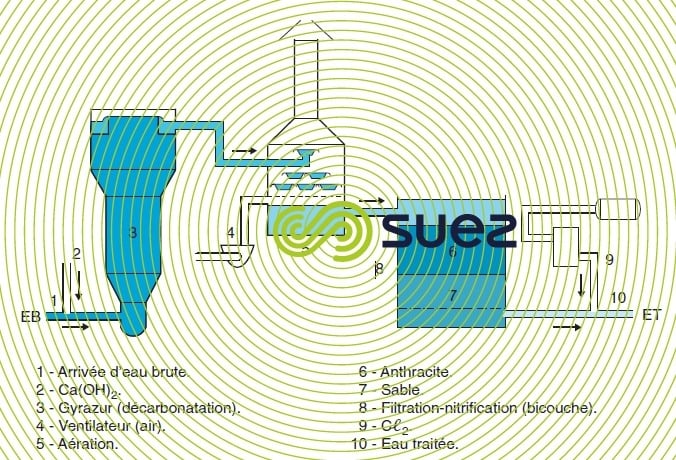
Une décarbonatation partielle, à pH voisin de 8, peut donc entraîner une déferrisation complète. Dans certains cas, en particulier dans les appareils de décarbonatation en lit fluidisé (voir la section sur le réacteur à masse de contact granualaire Gyrazur), le même pH permet une démanganisation satisfaisante, alors que théoriquement elle devrait être associée à une décarbonatation totale à pH 9,5 ou 10. C’est sur ce principe que fonctionne l’installation de Ratingen en Allemagne (figure 27) : cette installation réalise décarbonatation partielle, déferrisation, démanganisation et nitrification.


élimination biologique du fer – le procédé ferazur
principe
On a vu (voir les sections cycle du fer et du manganèse et déferrisation et démanganisation biologiques) que de nombreuses bactéries sont capables, grâce aux enzymes et biopolymères qu’elles élaborent, d’oxyder biologiquement le fer en catalysant l’oxydation du métal divalent par l’oxygène dissous, même en faible concentration, et en le fixant sur leurs membranes cellulaires, leurs gaines, leurs pédoncules… Les précipités formés sont alors fortement adhérents aux polymères bactériens. En outre, contrairement à ce qui se passe en déferrisation physico-chimique, ce sont des oxyhydroxydes de nature cristalline, en particulier de la lépidocrocite (γ-FeOOH). Les conditions de rétention du fer précipité sur les filtres biologiques sont donc bien meilleures que sur les stations fonctionnant dans le mode physico-chimique. Ces bactéries sont susceptibles de se développer dans des conditions où l’oxydation physico-chimique du fer n’est pas possible, par exemple :
- concentration en oxygène dissous 0,2 à 0,5 g · m–3 ;
- pH < 7,2 ;
- potentiel redox : 100 à 200 mV ;
- rH : légèrement supérieur à 14.
Si le rH est inférieur à 14, les bactéries restent inopérantes, alors que s’il est supérieur à une valeur de l’ordre de 20, il y a compétition avec l’oxydation et la précipitation physico-chimique. La figure 28 zone 1 définit le domaine privilégié de la déferrisation biologique.
En réalité, la limite de séparation entre les domaines de déferrisation physico-chimique et biologique est peu nette ; dans le domaine « physico-chimique », la présence d’un inhibiteur peut ralentir la cinétique d’oxydation et permettre à la déferrisation biologique d’être le processus prédominant. C’est la raison pour laquelle il est souvent utile de procéder à un essai pilote pour déterminer les conditions optimales de fonctionnement.


avantages de la déferrisation biologique
En comparaison avec le procédé physico-chimique, on peut les résumer de la façon suivante :
- oxydation rapide : tour d’oxydation inutile ; une injection d’air sous pression en ligne suffit ;
- réactifs (tels que : oxydant complémentaire, correction de pH, floculant) inutiles ;
- capacité de rétention importante : le fer oxydé est retenu sous forme beaucoup plus compacte. Il en résulte une capacité de rétention du filtre (toujours constitué de sable homogène dans ce cas) environ 5 fois plus importante ;
- vitesse de filtration élevée : grâce à la solidité du floc biologique et à une TE du sable plus élevée (1,1 à 1,5 mm), on peut filtrer environ cinq fois plus vite qu’en mode physico-chimique tout en conservant la même durée de cycle de filtration ; ces vitesses peuvent aller, dans certains cas, jusqu’à 40 m · h–1, voire 50 m · h–1 ;
- lavage économique : le pourcentage d’eau de lavage est environ 5 fois plus faible que dans le cas de la déferrisation physico-chimique et, dans certains cas, il est possible de laver les filtres à l’eau brute. Il est en revanche recommandé de ne pas laver les filtres à l’eau traitée chlorée, ce qui pourrait détruire partiellement la population de bactéries déferrisantes ;
- traitement des boues facilité : les eaux de lavage à plus forte concentration sont particulièrement aptes à l’épaississement et à la déshydratation.
mise en œuvre
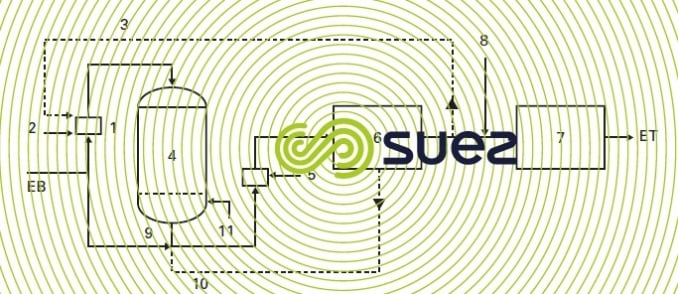
Une installation de déferrisation biologique sous pression comprend (figure 29) :
- un système d’aération ménagée (1) ; cette aération peut être réalisée soit dans un mélangeur statique ou un pot de dissolution pour les installations sous pression avec injection d’air (2), soit par recirculation d’une partie de l’eau traitée aérée (3) ;
- un réacteur Ferazur (4) à grande vitesse de passage ;
- éventuellement un système d’aération complémentaire (5) pour porter la teneur en oxygène à la valeur convenable pour distribution ;
- éventuellement une citerne d’eau de lavage non chlorée (6) si le lavage ne peut se faire à l’eau brute ;
- une citerne d’eau traitée (7), après chloration (8) ;
- un ensemble de lavage comprenant le lavage à l’eau brute (9) ou à l’eau traitée (10) et un surpresseur de lavage (11).


La photo 18 montre un exemple de réalisation.



La filtration peut aussi s’effectuer gravitairement en filtres ouverts, surtout pour les débits élevés, comme pour l’installation de Lomé (photo 19), où la cascade a été spécialement conçue, à partir des caractéristiques de l’eau brute, pour respecter les conditions nécessaires à la déferrisation biologique.



Remarque : le démarrage d’une installation de déferrisation biologique est moins rapide que dans le cas d’un traitement physico-chimique. Il demande un temps d’ensemencement (à partir des ferrobactéries naturellement présentes dans l’eau brute) généralement compris entre 1 et 10 jours.
Dans le cas où de l’H2S est présent, il faut l’éliminer soit par aération en tête (déferrisation gravitaire), soit par voie biologique (traitement sous pression), (voir la section élimination de l'h2s).
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













