élimination du manganèse
Temps de lecture :états naturels
Le manganèse est un élément très souvent présent dans les sols. On peut rencontrer de nombreux minerais de manganèse, généralement des oxydes (pyrolusite, vernadite…) et quelquefois des carbonates (rhodocrosite), des silicates, des sulfures…
Dans les eaux naturelles, le manganèse est généralement présent sous forme soluble ionisée Mn2+, parfois MnOH+ (pH très alcalin). Il peut former des complexes avec les bicarbonates, les sulfates et les silicates présents en même temps, ainsi qu’avec certaines MO (acides humiques et fulviques). Le manganèse est souvent présent dans les eaux naturelles en association avec le fer et l’ammonium. Mais il existe aussi des cas où le manganèse est présent seul.
élimination physico-chimique du manganèse
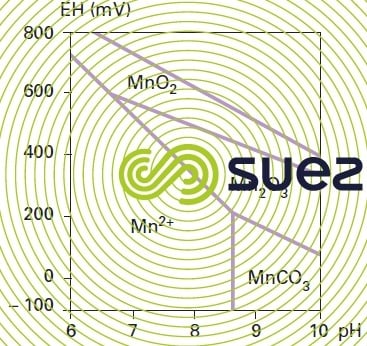
La figure 30 présente le diagramme de stabilité des formes les plus usuelles du manganèse.


oxydation par l’oxygène
Le manganèse Mn2+ est très lentement oxydable en MnO2 par l’oxygène, suivant une cinétique de la forme :

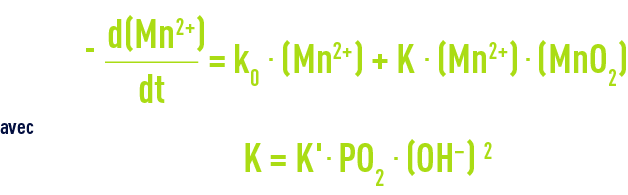
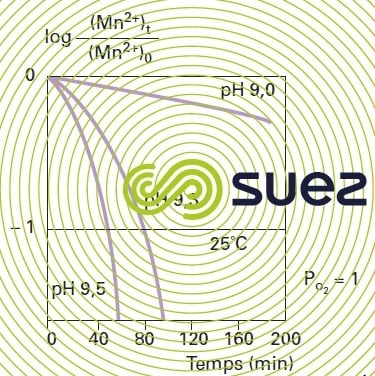
L’oxydation par l’oxygène n’atteint une vitesse appréciable que pour un pH supérieur à 9,5 (figure 31). L’oxydation de Mn2+ par l’oxygène dépend de la température : elle est 5 fois plus rapide quand on passe de 11 °C à 22 °C ; mais aux pH habituels, les temps de contact restent difficilement compatibles avec une exploitation industrielle.
La présence de dioxyde de manganèse « catalyse » la réaction. C’est ce qui est observé sur certaines installations travaillant à pH élevé où, après un certain temps de fonctionnement avec d’autres oxydants, le sable est enrobé par un dépôt de MnO2. Cet effet est toutefois insuffisant pour obtenir une eau traitée complètement dépourvue de manganèse.


oxydation par MnO2
On a aussi constaté que, à pH moins élevé, le MnO2 ne joue plus le rôle de catalyseur mais un rôle oxydant selon la réaction :


Il faut dans ce cas le régénérer périodiquement par du permanganate

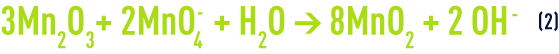
Le bilan global des réactions (1) et (2) est :

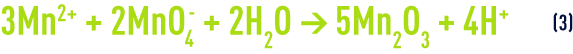
Dans la pratique, au lieu de chercher à manganiser un sable, on peut utiliser un matériau filtrant constitué de MnO2 (« sable vert manganisé », « polarite »…) qui peut être mélangé en proportion plus ou moins importante avec du sable et qui doit, lui aussi, être régénéré à intervalles réguliers.
oxydation par le chlore
Le chlore n’est pas plus capable que l’oxygène d’oxyder le manganèse à pH < 9,5, mais ces mêmes mélanges filtrants peuvent être utilisés (pH ≥ 8) comme catalyseurs de l’oxydation du Mn2+ par le chlore, parfois après une décantation et une première filtration en milieu acide pour éliminer les MO (cas de certaines eaux de surface douces et colorées).
oxydation par le dioxyde de chlore
Comme déjà vu à la section oxydation et réduction, cette réaction est relativement lente et en présence de MO produit des chlorites, elle n’est donc pas recommandée.
oxydation par le permanganate de potassium
Il y a oxydoréduction entre le manganèse manganeux et le permanganate suivant la réaction (3) ci-avant.
On observe donc que la consommation de KMnO4 est la même que lorsqu’on passe par l’intermédiaire d’une oxydation au MnO2 régénéré par KMnO4; l’avantage de cette dernière méthode est de disposer d’un « régulateur » en cas de variations de la concentration en Mn2+, et on peut alors distribuer une dose constante de KMnO4 réglée sur une moyenne (« régénération continue »).
La proportion théorique est de 1,9 g de KMnO4 pour 1 g de Mn, mais en pratique elle varie avec le pH et la composition de l’eau. En effet, une partie du permanganate participe à l’oxydation de certaines MO réductrices présentes dans l’eau. En outre, il est indispensable de bien contrôler la dose introduite : un excès de KMnO4 donne à l’eau une couleur rose, virant ensuite au jaune dans le réseau de distribution.
Si le manganèse n’est pas complexé, le pH optimal se situe vers 7,2-7,3 pour un temps de contact inférieur à 5 min Lorsque le manganèse est complexé à des MO, le temps de réaction peut monter jusqu’à 20 min. Il est possible, dans ce cas, de régler le pH au-dessus de 8,5 pour accélérer la réaction.
C’est le KMnO4 qui est en pratique le réactif le plus utilisé en démanganisation physico-chimique. Sur les eaux souterraines, la conception des stations est la même qu’en déferrisation simple (figures 22 et 23) : que l’eau contienne du manganèse seulement ou du fer et du manganèse, on procède d’abord à une aération (ouverte ou sous pression), toujours indispensable pour agir sur les substances facilement oxydables (Fe2+ , H2S…) et enrichir l’eau en O2 dissous (protection contre la corrosion et les odeurs désagréables dans le réseau) ; le permanganate est ensuite introduit, comme les autres réactifs éventuels, entre l’aération et la filtration (laquelle s’effectue aux mêmes vitesses, mais avec un sable plus fin si l’eau ne contient que du manganèse : TE = 0,55 à 0,75 mm).
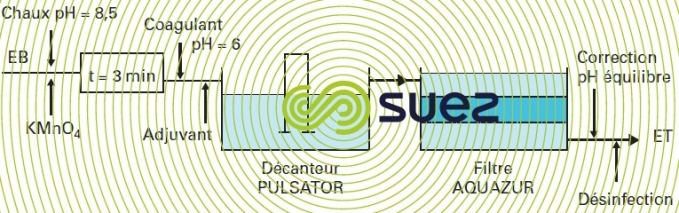
Sur des eaux de surface douces, colorées, contenant une quantité importante de MO, et nécessitant une clarification totale par coagulation-floculation avec décantation (eaux de régions granitiques des massifs primaires, par ex.), la chaîne de traitement à mettre en œuvre peut être conçue suivant le schéma représenté sur la figure 32, ce qui constitue une variante de la filière évoquée plus haut avec chlore et matériau « manganisé ».


oxydation par l’ozone
L’oxydation de l’ion manganeux Mn2+ par l’ozone est rapide. La réaction est la suivante :


Pour oxyder 1 g de Mn2+, il faut 0,9 g d’ozone. La dose d’ozone introduite doit conduire seulement à l’oxydation du Mn2+ en MnO2 et sans excès (couleur rose…), (voir la section oxydation et désinfection par l'ozone).
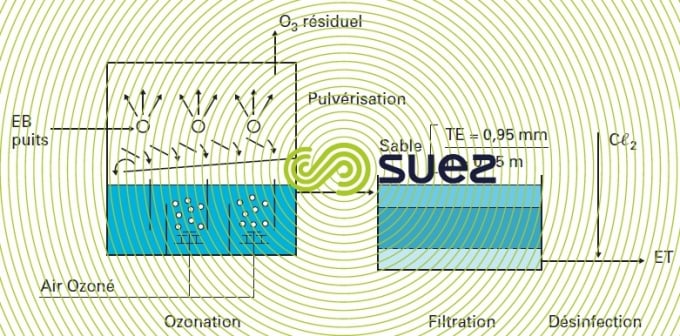
L’installation de Jonchay (France) est basée sur ce principe (figure 33).


Lorsque le manganèse est complexé à des MO et nécessite une clarification complète par coagulation-floculation-décantation, l’ozone ne peut être utilisé comme préoxydant pour oxyder le manganèse. En effet, l’ozone n’oxyde le manganèse qu’après avoir détruit le complexe organomanganeux, ce qui entraîne d’une part une consommation exagérée et peu économique d’ozone, d’autre part une stabilisation des colloïdes (d’où coagulation et floculation difficiles). Dans ce cas, le manganèse peut être éliminé de deux façons : soit par utilisation du KMnO4 avant décantation, comme indiqué figure 32, soit par ozonation de l’eau décantée, le précipité de MnO2 étant alors retenu sur les filtres.
élimination biologique du manganèse – le procédé mangazur
principe
Comme pour le fer, de nombreuses bactéries (voir la section cycle du fer et du manganèse) permettent, en milieu aérobie, une oxydation biologique du manganèse par l’oxygène.
Pour certaines bactéries, l’oxydation du Mn2+ est indirecte : elle est due à une augmentation du pH liée à la croissance de ces bactéries, ce qui permet l’oxydation de Mn2+ par l’oxygène à une vitesse appréciable. Pour d’autres bactéries, elle est due à l’action d’une enzyme intracellulaire. Pour d’autres enfin, le manganèse dissous commence par s’adsorber à la surface de la membrane cellulaire. Il est ensuite oxydé par voie enzymatique. Le manganèse se concentre alors en une gaine entourant la cellule ou un groupe de cellules.
Ces bactéries exigent, pour leur développement, un milieu relativement alcalin (pH > 7,5), dont le EH doit être supérieur à 400 mV (ce qui correspond à une eau au voisinage de la saturation en O2 dissous) : voir figure 28 le domaine (2) de la démanganisation biologique. En revanche, si ce potentiel diminue fortement, certaines de ces bactéries sont capables de solubiliser (passage MnO2 à Mn2+) le manganèse qu’elles ont précédemment accumulé.
De même en présence de MO facilement assimilables, des bactéries liées au carbone peuvent entrer en compétition avec les bactéries liées au Mn dans la consommation de l’oxygène dissous, ce qui peut se traduire par une baisse du EH et un relargage de Mn2+, lors de périodes d’arrêt par exemple.
avantages de la démanganisation biologique
réactifs
Pas de réactifs en fonctionnement normal. Il peut être cependant utile d’utiliser un oxydant, généralement le permanganate de potassium, pendant la période de démarrage.
aération
Le temps de contact est court sur la plupart des eaux. C’est le temps nécessaire à l’élévation du potentiel d’oxydoréduction. L’aération peut se réaliser en ligne (sous pression) ou par cascade (gravitaire).
vitesse de filtration
La solidité du floc biologique permet, comme pour la déferrisation biologique, d’adopter des vitesses de filtration élevées, pouvant aller, dans certains cas, jusqu’à 30-40 m · h–1, sur des matériaux filtrants dont la taille effective est plus élevée (TE = 1,35 mm) que dans le cas de la démanganisation physico-chimique.
capacité de rétention
Elle est 5 à 10 fois plus élevée qu’en mode physico-chimique.
lavage
Il peut être réalisé à l’eau brute (ou à l’eau traitée non chlorée).
boues
Les boues sont aisées à épaissir et déshydrater.
mise en œuvre
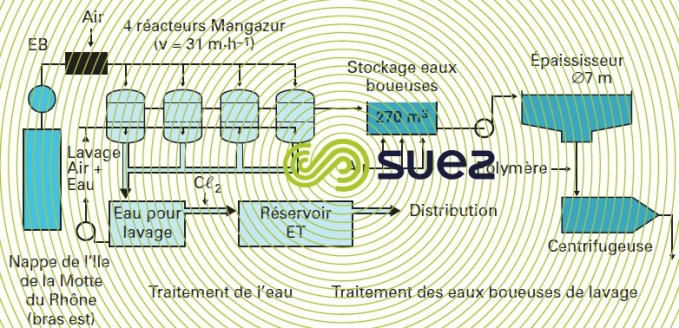
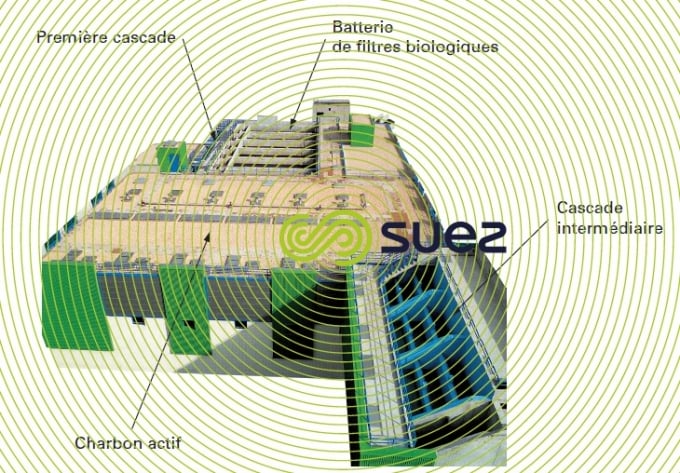
Le procédé, de même que le réacteur-filtre biologique où il s’effectue, est appelé Mangazur. La station sous pression est la solution la plus fréquemment adoptée (sauf débit élevé), comme c’est par exemple le cas pour celle de Sorgues (syndicat de Rhône-Ventoux) qui est décrite sur la figure 34.


Un autre exemple, réalisé au Canada, est illustré par la photo 20.



Le développement des bactéries impliquées dans la démanganisation biologique est beaucoup plus lent que celui des bactéries de la déferrisation. Le démarrage de l’installation est donc beaucoup plus long et peut nécessiter un temps d’ensemencement naturel compris entre 1 et 3 mois (c’est du reste la raison pour laquelle la faisabilité d’un tel procédé n’a été découverte que tardivement, en analysant le fonctionnement de certaines stations existantes).
On peut raccourcir ce délai en utilisant du sable préalablement colonisé par des bactéries sur une installation similaire.
cas des eaux contenant du fer et du manganèse
Lorsqu’une eau contient simultanément du fer et du manganèse, on se heurte à l’obligation d’observer des conditions de potentiel Redox différentes pour l’oxydation de ces deux éléments par voie biologique (figure 28). En outre, l’élimination du manganèse ne peut commencer que lorsque celle du fer est terminée. Dans de très rares cas, on observe leur élimination simultanée dans le même filtre, mais seulement si les caractéristiques de l’eau brute sont très favorables et au prix d’une vitesse limitée ; c’est le cas de la station gravitaire de Poncey, près de Dijon (photo 21), qui traite un débit nominal de 3 000 m3·h–1 par aération ménagée et filtration sur un étage unique de six filtres à sable, à une vitesse de 15 m · h–1 en moyenne et de 19 m · h–1 en pointe, à partir des caractéristiques d’eau brute suivantes :
- Fer = 0,2 à 1 mg · L–1 ;
- Manganèse = 0,2 à 0,5 mg · L–1 ;
- pH = 7 à 7,2 ;
- NH4 = Traces à 0,1 mg · L–1.


Cette solution n’a pu être adoptée qu’après une longue campagne d’essais sur station-pilote (plus de 6 mois). Dans la plupart des autres cas, on adopte le schéma suivant, basé sur deux étages successifs de filtration :
- première aération, réglée pour la déferrisation biologique ;
- première filtration (déferrisation biologique) ;
- deuxième aération et/ou relèvement du pH (suivant les caractéristiques de l’eau brute et le réglage du premier étage) ;
- deuxième filtration (démanganisation biologique).
Suivant les conditions locales, la station pourra comporter :
- deux étages sous pression (voir un exemple sur la photo 22) ;
- deux étages gravitaires (grandes stations), décalés en hauteur pour que l’eau passe du premier au - second ;
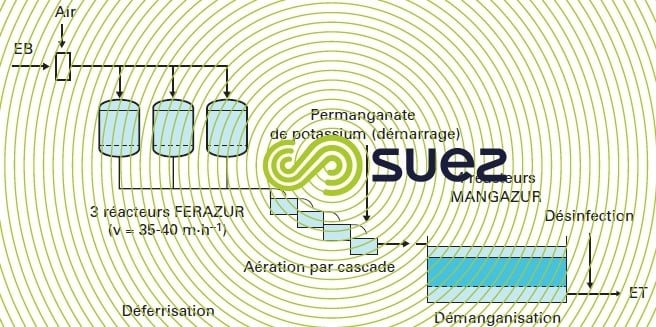
- une solution mixte comme sur l’installation de Mommenheim dont le schéma est donné à la figure 35 : la déferrisation biologique est réalisée sous pression, alors que la démanganisation biologique est gravitaire : une injection de permanganate a été réalisée sur la cascade au démarrage de l’installation en attendant l’ensemencement, lequel a ensuite été très rapide et a permis de porter les cycles de filtration du deuxième étage de 24 h en moyenne (mode physico-chimique) à 1-2 semaines (mode biologique).
Malgré la nécessité d’adopter le plus souvent 2 étages de filtration lorsqu’une eau contient simultanément Fe + Mn, la solution biologique reste généralement plus économique que le traitement physico-chimique et toujours plus facile à exploiter. En revanche, autant la déferrisation biologique est maintenant bien maîtrisée (une bonne analyse permet de faire un projet sûr), la démanganisation biologique, du fait des pH et surtout EH élevés nécessaires, connaît des interférences (NH4, H2S, MO, eaux à pHS bas…) : aussi, il reste souvent prudent d’effectuer des essais pilotes au préalable.





Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













