étude du pouvoir adsorbant d'un charbon
Temps de lecture :granulométrie d’un charbon actif en poudre ( CAP )
Sécher le charbon pendant 4 heures à 120 °C. Peser avec exactitude environ 10 g de charbon que l’on dépose sur le premier tamis (125 mm). Après l’avoir mouillé, on passe le tamis sous le jet du robinet d’eau sous pression modérée, en lavant le charbon qui reste sur le tamis. On procède au-dessus d’un pot émaillé blanc, et on poursuit le lavage jusqu’à ce que l’on constate qu’il ne passe plus de charbon à travers le tamis. Mettre alors le tamis à l’étuve pendant 4 heures à 120 °C pour séchage. Peser ce qui est resté sur le tamis. Calculer par différence avec le chiffre original la quantité de charbon qui est passée à travers le tamis. Exprimer le rapport en pourcentage.
Opérer de même avec les tamis de taille inférieure (90‑63‑45 mm).
isotherme d’adsorption = isotherme de Freudlich
Le pouvoir adsorbant d’un charbon actif vis-à-vis d’un polluant donné peut être estimé à l’aide d’une isotherme d’adsorption.
Le modèle de Freundlich (voir adsorption) établit la relation entre la masse de polluant retenue par unité de masse de charbon


et la concentration du polluant en phase aqueuse à l’équilibre Ce avec le charbon

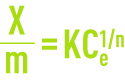
K et n, deux coefficients définis par l’expérience.
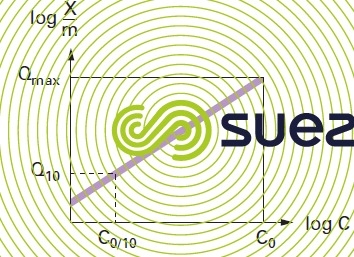
À partir de ces courbes isothermes voir ex. figure 25, on peut définir :
- une capacité maximale d’adsorption d’un charbon qui permet d’estimer la masse maximale de polluant retenue à l’équilibre par unité de masse de charbon, pour une concentration de polluant en phase aqueuse, égale à la concentration initiale de polluant introduite ;
- un indice d’adsorption (Q10) d’un polluant défini comme la masse de polluant retenue par unité de masse d’adsorbant pour une concentration de polluant égale à un dixième de la concentration initiale de polluant. Cet indice permet d’estimer la capacité d’adsorption du charbon pour des conditions moyennes plus proches du fonctionnement habituel du charbon en lit fixe.
Si ces capacités, indices, doivent servir de point de comparaison entre différents fournisseurs et/ou de méthode de réception d’un charbon actif, il faut au préalable convenir d’un mode opératoire très précis avec les différents fournisseurs.


établissement d’une isotherme
- prendre six flacons en verre de 1,2 litre ;
- introduire 1 litre de l’eau contenant le polluant dont on désire étudier l’élimination. (remarque : si le polluant est volatil, les flacons doivent être remplis complètement afin d’éviter des pertes de masse par volatilisation) ;
- si on étudie une eau naturellement polluée, on introduit l’eau telle qu’elle se trouve ;
- si on étudie une eau synthétique, on introduit généralement une masse de 1 mg du polluant testé dans chaque flacon, cas d’une étude en vue d’une potabilisation d’eau (remarque : en ERI on fera de même en ajoutant 10 – 100 – 1 000 mg par flacon suivant le cas simulé) ;
- réduire le charbon étudié à l’état de poudre en le pulvérisant dans un mortier et en le tamisant par voie sèche sur un tamis de 40 µm. On retient les particules passant à travers le tamis ;
- sécher le charbon 4 h à 120 °C dans un poudrier ;
- on introduit des doses de charbon croissantes exactement pesées dans les flacons contenant l’eau polluée à étudier :


Après un minimum de 5 jours d’agitation modérée (30 à 40 tours·min–1) à température constante, on filtre chaque échantillon sur une membrane d’acétate de cellulose de 0,45 µm. Éliminer les 100 premiers millilitres et doser le polluant restant sur le reste du filtrat. Pour chaque dose de charbon, on obtient ainsi la concentration à l’équilibre du polluant dans l’eau après contact.
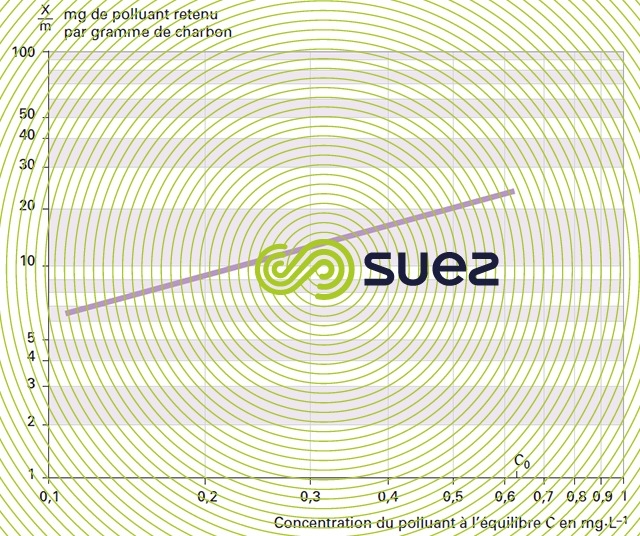
Tracer la courbe isotherme en coordonnées log-log en portant en abscisse la concentration à l’équilibre exprimée en mg · L–1 et en ordonnée la masse de polluant en milligrammes retenue par gramme de charbon (figure 26).


étude cinétique
Dans le cas de charbons en grains on peut aussi réaliser la mise en contact sans broyer le charbon, en poursuivant l’agitation sur une durée importante (plusieurs semaines). La mesure de la concentration à l’équilibre à différents temps de contact permet la modélisation de l’adsorption du polluant étudié.
cendres du charbon
Peser exactement environ 1 g de charbon sec et l’introduire dans un creuset à calcination, soit P1 le poids pesé.
Calciner le charbon étudié à 625 °C (± 25 °C). Bien vérifier que la calcination est complète. Après refroidissement, peser les cendres, soit P2.
On exprime la teneur en cendre C :

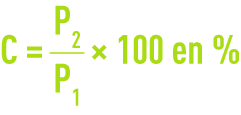
indice d’iode
À partir du tracé de l’isotherme d’iode du charbon considéré, son indice d’iode représente le nombre de milligrammes d’iode absorbés par gramme de charbon pour une concentration en iode résiduel dans le filtrat de 0,02 N.
pouvoir de déchloration
On caractérise le pouvoir déchlorant d’un charbon par la hauteur de lit nécessaire pour obtenir une réduction de la moitié de la dose de chlore existante pour une vitesse de percolation de 20 m · h–1.
Débarrasser tout le charbon de l’air qu’il est susceptible de contenir en le faisant bouillir dans de l’eau distillée. Placer le charbon humide à l’abri de l’air dans un tube (diamètre 22 mm), jusqu’à obtention d’une colonne de 10 cm de hauteur exactement mesurée.
Préparer une solution d’eau chlorée contenant 10 mg · L–1 de chlore actif à partir d’une solution d’hypochlorite de sodium, à pH 7,5.
Faire passer cette eau chlorée sur la colonne de charbon à la vitesse de 20 m · h–1. Après 30 minutes de fonctionnement, titrer exactement l’eau chlorée à l’entrée de la colonne (soit a en mg · L–1) et à la sortie de la colonne (soit b en mg · L–1).
H étant la hauteur de couche en cm, calculer la longueur de demi-déchloration G (en cm) :

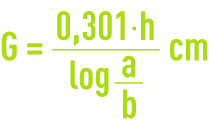
Ce test peut être reproduit avec les mêmes conditions opératoires pour d’autres oxydants comme les chloramines, le dioxyde de chlore…
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












