transformations de l'azote
Temps de lecture :Dans les eaux naturelles, l’azote est généralement présent sous forme ammoniacale et/ou nitrique ; il n’y a donc pas lieu de considérer les phases d’ammonification et d’assimilation citées à propos des ERU et des ERI (voir cultures libres (boues activées)) et les seuls traitements pratiqués en EP concernent l’élimination des ions NH4+ et NO3-.
nitrification
théorie du procédé
On peut éliminer l’ammonium :
- soit par voie physico-chimique : chloration au point critique (ou break-point, voir les oxydants et désinfectants Action de l’azote ammoniacal) ; ce traitement est coûteux et engendre des produits organochlorés (en particulier THM) ; il est donc de moins en moins appliqué, sauf sur des eaux très propres et à faible teneur en NH4 ;
- soit par voie biologique : nitrification, qui consiste à transformer, par oxydation enzymatique, l’ammonium en nitrites, puis en nitrates, sous l’influence de bactéries spécifiques.
Les bactéries nitrifiantes sont autotrophes ; dans ce cas précis, pour former leur substance à partir du carbone minéral de l’eau (CO2, HCO3-), elles tirent leur énergie de l’oxydation des formes réduites de l’azote :
- transformation de l’ammonium en nitrites (« nitritation ») sous l’influence de bactéries dont le genre prédominant est Nitrosomonas :

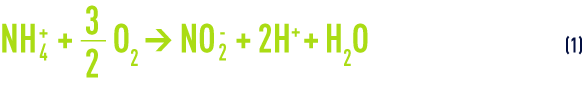
- puis conversion des nitrites en nitrates (« nitratation ») par d’autres bactéries, dont le genre prédominant est Nitrobacter :


La réaction globale de la nitrification (voir aussi cultures libres (boues activées)) s’obtient en additionnant membre à membre les équations (1) et (2) :

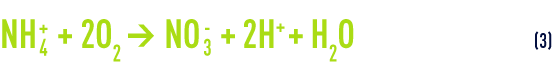
En EP, les teneurs en ammonium sont généralement exprimées en ions NH4+, conformément aux normes (alors qu’en ERU et ERI, l’unité est plutôt le mg · L–1 d’azote ammoniacal). De la réaction (3), on peut donc conclure qu’il faut environ 3,6 g d’oxygène pour oxyder 1 g d’ion NH4+ (ou 4,6 g pour 1 g de N-NH4), et que ce processus est acidifiant (libération d’ions H+).
Les bactéries nitrifiantes étant autotrophes et aérobies, leur mise en œuvre ne nécessite qu’un apport d’O2 (aération) plus des traces de phosphore (0,1 à 0,2 g · m–3, en PO43–) pour pouvoir synthétiser leur ADN et leur ATP. Il faut éventuellement ajouter un produit alcalin dans les eaux à forte concentration en NH4+ et à faible TAC, afin de maintenir le pH à une valeur supérieure à 7,2.
cinétique de la nitrification
Comme toutes les réactions chimiques ou biochimiques, il faut un certain temps avant que celles de la nitrification soient complètes ; contrairement à ce qui se passe pour la déferrisation et la démanganisation biologiques, la cinétique de réaction est ici relativement lente ; elle est de plus fortement influencée par le pH et par la température.
Dans la zone de pH optimal (7,2 à 8,5), une formule empirique permet de calculer rapidement les caractéristiques d’un réacteur de nitrification ; ce calcul est fondé sur la relation :

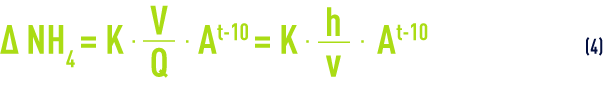
avec :
Δ NH4 = quantité d’ion ammonium à éliminer (mg · L–1)
Q = débit d’eau (m3·h–1)
V = volume de la masse de contact (m3)
h = hauteur de la masse de contact
v = vitesse de passage de l’eau (m · h–1 ou m3 · h–1·m–2)
t = température (°C)
A, K = coefficients expérimentaux, fonction de la biomasse, du matériau support (sable, biolite (voir filtres biologiques (ou biofiltres), CAG…) et de la technologie de sa mise en œuvre (en particulier, suivant que le réacteur subit ou non une aération in situ).
mise en œuvre de la nitrification
On vient de voir les deux facteurs limitants d’un traitement de nitrification :
- la disponibilité en oxygène dissous, à raison de 3,6 ppm O2 pour éliminer 1 ppm NH4+ ; sachant qu’il faut en outre garder un « talon » de 1,5 à 2 ppm O2 dans l’eau traitée, on voit qu’une eau ayant subi une aération lui ayant apporté 80 % de la saturation en O2 (cas assez courant) ne peut voir disparaître guère plus de 1,5 à 2 ppm NH4+ par nitrification, du moins sans apport complémentaire d’oxygène ; on peut aussi remarquer que pour une même technologie d’aération préliminaire, la capacité de nitrification augmente si la température baisse (variations de la solubilité de l’oxygène en fonction de la température) ;
- la cinétique de nitrification à laquelle, d’après la relation (4), une baisse de la température est au contraire défavorable.
Sur un lit filtrant, on peut donc rencontrer les mêmes cinétiques apparentes de nitrification à (par exemple) 5 °C et 30 °C, mais pour différentes raisons :
- moins d’oxygène dissous en eau chaude ;
- réactions plus lentes en eau froide.
Dans la pratique :
- les faibles teneurs en NH4+ (ð 1 mg · L–1), présentes dans des eaux bien aérées, peuvent être directement éliminées par cette voie sur des filtres à sable, en l’absence de tout désinfectant résiduel (toutefois, une ozonation préalable paraît favoriser ce développement bactérien) ; si les maxima en ammonium risquent de se présenter en période d’eau froide ou si 1 mg · L–1 < NH4+ < 2, on peut pour augmenter la biomasse disponible remplacer le sable par de la biolite de même granulométrie, constituant ainsi un « lit filtrant nitrifiant » (voir élimination de l'ammonium) ; une variante existe aussi en lit flottant (voir filtres filtrazur et élimination de l'ammonium) ;
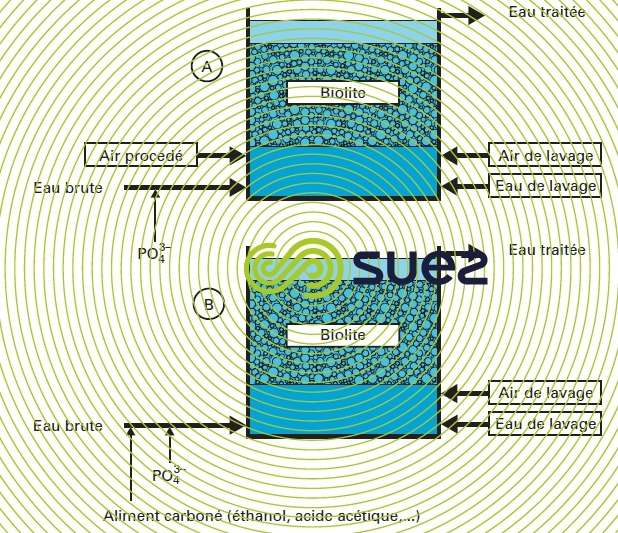
- la nitrification des eaux claires à forte teneur en NH4+ est mise en œuvre dans des biofiltres aérés, où l’eau et l’air circulent à co-courant ou à contre-courant, avec un rapport volumique [air (Nm3 · h–1)/eau (m3 · h–1)] voisin de 1 ; la masse granulaire du biofiltre peut théoriquement être constituée de sable ou de pouzzolane de fine granulométrie (voir aussi élimination de l'ammonium), mais les appareils les plus performants sont remplis de biolite comme dans le nitrificateur Nitrazur N degremont® (figure 45), appareil analogue au Biofor N utilisé en eaux résiduaires, dans lequel l’eau et l’air circulent à co-courant. Ces réacteurs doivent être suivis d’une filtration sur sable.
dénitrification
Le procédé biologique le plus couramment appliqué pour l’élimination des nitrates met en œuvre des bactéries hétérotrophes, à qui il faut donc fournir un aliment carboné (le plus souvent de l’éthanol). Celui-ci est utilisé grâce à l’oxygène pris aux nitrates, lesquels sont ainsi convertis en azote. Ces bactéries étant facultativement aérobies, il faut que le milieu soit dépourvu d’oxygène dissous pour que les nitrates soient décomposés. D’autre part, une source de phosphore est indispensable, comme en nitrification.
Un tel traitement est mis en œuvre dans un biofiltre à matériau granulaire spécial, tel que la biolite. Le procédé Nitrazur DN correspondant (voisin du Biofor DN), développé par SUEZ, est décrit plus en détail dans élimination des nitrates. La figure 45 récapitule les différences essentielles de conception qui existent entre un Nitrazur N (voir transformations de l'azote) et un Nitrazur DN.


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.
















