transfert de l'ozone
Temps de lecture :L’ozone produit se trouve sous forme gazeuse, dilué dans de l’air ou de l’oxygène. Il est principalement utilisé sous forme dissoute pour réagir selon les réactions décrites dans les oxydants et désinfectants). La réactivité est donc subordonnée à la quantité d’ozone transférée en phase aqueuse. L’ozone doit tout d’abord diffuser en phase gazeuse vers l’interface gaz-liquide, puis se dissoudre dans le liquide et, par la suite, diffuser au sein même du liquide.
La vitesse de transfert dépend :
- des propriétés physiques des deux phases en présence ;
- de la différence de concentration de chaque côté de l’interface liée à la vitesse de réaction chimique qui consomme l’ozone ;
- du degré de turbulence du milieu.
modélisation du transfert de l’ozone
L’équation générale de transfert s’écrit :


Plusieurs modèles, fondés sur des hypothèses distinctes quant au comportement du liquide, permettent de représenter le transfert de l’ozone en phase aqueuse. On distingue ainsi le modèle du double film, les modèles à renouvellement de surface, les modèles de pénétration, les modèles combinés… Le modèle le plus simple et le plus couramment utilisé est le modèle du double film de Lewis et Whitman (figure 13).

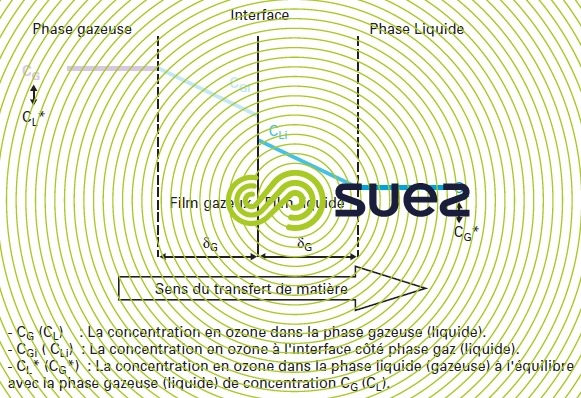

Ce modèle repose sur les hypothèses suivantes :
- il existe entre les phases gazeuse et liquide une interface sans épaisseur ;
- de part et d’autre de l’interface séparant les deux phases, un film gazeux (d’épaisseur δG) et un film liquide (d’épaisseur δL) sont le siège de la résistance au transfert ; chacun est caractérisé par un coefficient de transfert propre ;
- à l’interface, les phases en contact sont en équilibre et les concentrations suivent la loi de Henry : CGi = m·CLi où m est le coefficient de partage relié à la constante de Henry ;
- à l’extérieur des deux films, la concentration au sein de chaque phase est homogène ;
- le transport à travers les deux films se produit en régime permanent.
La quantité transférée par unité de temps N à travers l’interface (hors réaction chimique) est alors décrite par :


avec kG et kL (KG et KL), les coefficients de transfert de matière (globaux) au sein de chaque phase et A, l’aire interfaciale d’échange.
Comme l’ozone est faiblement soluble dans l’eau, la résistance au transfert de matière est localisée dans le film côté liquide et il s’ensuit :

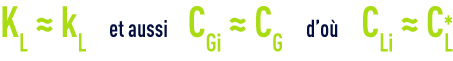
et en exprimant A en fonction de a aire d’échange par unité de volume de la phase liquide, l’équation de transfert fait apparaître le produit kL· a appelé paramètre global de transfert de matière :

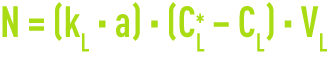
Cette dernière équation est à la base de l’estimation de la vitesse du transfert de matière lorsque l’on considère n’importe quel échangeur de matière (absorbeur ou contacteur). Afin de l’appliquer dans la pratique, il est nécessaire de connaître l’ensemble de ces paramètres :
- kL · a : il dépend des conditions hydrodynamiques de la phase liquide ;
- CL : elle dépend des conditions d’agitation et de la vitesse de réaction chimique ;
- CL* : cette concentration en phase liquide à saturation dépend de la concentration en phase gazeuse, de la température, de la pression et de la composition de la phase liquide.
concentration de l’ozone à saturation
La concentration en ozone à saturation CL* représente la concentration en ozone dissous à l’équilibre avec la concentration en phase gazeuse de température et pression données en l’absence de réaction. Elle est abusivement appelée solubilité alors qu’en toute rigueur, la solubilité d’un gaz est précisément définie comme la concentration de gaz dissous à l’équilibre dans les conditions normales de température et de pression (0 °C et 1 atm). L’ozone étant peu soluble dans l’eau, l’équilibre obéit à la loi de Henry. : x · He = y · P où x(y) est la fraction molaire de l’ozone en phase liquide (gazeuse), P la pression du gaz et He la constante de Henry. En considérant que l’ozone est un gaz parfait qui produit des solutions aqueuses diluées (x < 0,05), le coefficient de partage usuel m aussi appelé rapport de solubilité noté α et défini comme le rapport des concentrations exprimées dans la même unité (g ou mol · m–3), CL* = m · CG est donc relié à la constante de Henry par :

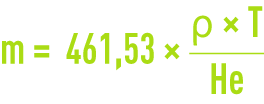
où ρ est la masse volumique de l’eau (en kg·m3) à la température T (en K) et He en Pa pour P = 1 atm ou 101,325 kPa.
Il apparaît que He, ρ et donc m varient avec la température. Les résultats des études les plus récentes sont correctement décrits par la loi empirique :


où la température T est exprimée en °C et P = 1 atm.
Les différentes équations montrent que trois paramètres physiques ont un effet majeur sur l’équilibre des concentrations en ozone en phase gazeuse et en phase liquide :
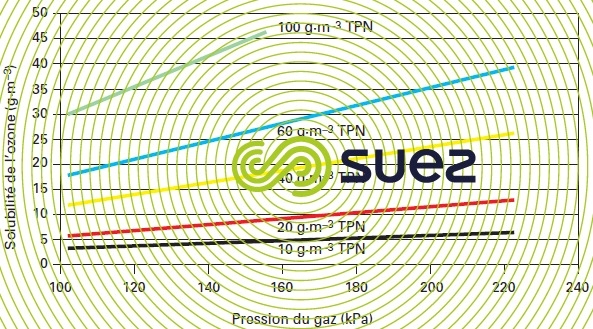
- l’augmentation de la pression du gaz ou de la concentration en phase gazeuse qui engendrent une augmentation linéaire de la concentration en ozone dissous à saturation pour la température considérée (figure 14).
- à l’inverse, la concentration en ozone dissous à saturation diminue lorsque la température croît (figure 36, constantes caractéristiques des gaz) et que les autres paramètres sont invariants.


En pratique, d’autres paramètres affectent l’équilibre. Les plus importants sont le pH et la force ionique :
- le pH influence la vitesse de décomposition de l’ozone. L’effet de l’élévation de pH est très sensible dès pH égal à 8 et se traduit par une diminution de la concentration en ozone à l’équilibre (voir figure 37, constantes caractéristiques des gaz). Ainsi, les données expérimentales convergent vers l’expression d’une constante de Henry apparente :


où He apparent est en atm, la température T en K et [OH–] en mol · L–1 ;
- l’effet de la force ionique sur la concentration en ozone dissous à l’équilibre devient significatif lorsque la teneur en minéraux dissous dépasse 1 000 mg · L–1.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













