les oxydants et désinfectants
Temps de lecture :l’oxygène
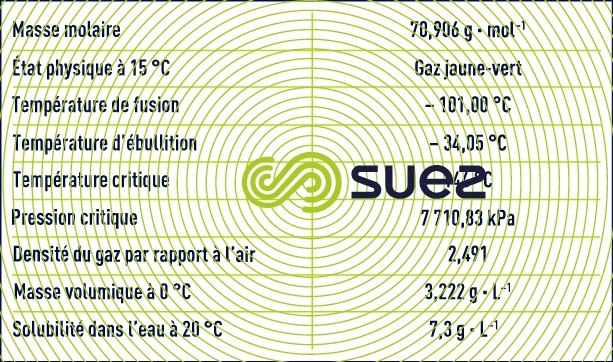
L’oxygène est l’élément le plus abondant dans la nature. Sous sa forme moléculaire O2, l’oxygène ou « dioxygène » est un gaz incolore et relativement peu soluble dans l’eau (voir constantes caractéristiques des gaz).
Ainsi que le montrent les équations d’oxydoréduction, le pouvoir oxydant de l’oxygène dépend fortement du pH et est faible par rapport à celui des autres oxydants employés. Ainsi à pH neutre, le potentiel d’oxydoréduction lié à l’oxygène s’élève à + 0,815 V. Ceci justifie que l’oxygène dissous dans les eaux ne soit capable d’oxyder que certains composés comme le fer ferreux. La déferrisation constitue la principale application de l’oxygène en tant qu’oxydant chimique :


La réaction est d’autant plus rapide que le pH est élevé. L’oxygénation de l’eau par aération ouverte a pour effet secondaire d’éliminer les gaz dissous tels que le sulfure d’hydrogène H2S et le dioxyde de carbone CO2 (voir Équilibre calcocarbonique, décantation).
L’oxygène dans son état électronique fondamental triplet a le comportement d’un diradical. Il est alors chimiquement inerte par rapport à la matière organique ce qui explique que les organismes vivants continuent à exister. Trois principales techniques peuvent être employées pour exacerber la réactivité de l’oxygène :
- l’excitation en oxygène à l’état singulet par irradiation ultraviolette en présence de photosensibilisateurs (voie appliquée en synthèse organique) ;
- la complexation de l’oxygène avec des métaux de transition (voie d’action des enzymes oxygénase par exemple) ;
- la réduction de l’oxygène en anion radical superoxyde O2°– lequel est en équilibre acido-basique avec le radical hydroperoxyle HOO°, ces deux espèces étant capables d’initier un mécanisme d’oxydation radicalaire.
Seuls les deux derniers mécanismes sont actuellement mis en œuvre dans les réactions d’oxygénation des composés organiques en traitement d’eau. Les procédés dérivés sont appelés procédés d’oxydation en voie humide ( OVH ) et fonctionnent à température et pression élevées pour augmenter les vitesses de réaction. Selon les conditions de fonctionnement et les catalyseurs utilisés, l’oxygène est alors capable d’oxyder de nombreux composés organiques. Ce type de procédé est appliqué au traitement d’effluents industriels concentrés ou au traitement des boues (voir la destruction de la matière organique par voix humide (ovh)).
le chlore et l’hypochlorite
Le chlore de formule chimique Cℓ2 est un gaz à température et pression normales.


Le chlore injecté dans l’eau se dismute très rapidement en acide hypochloreux et acide chlorhydrique selon une réaction endothermique.


L’hydrolyse du chlore est complète en quelques dixièmes de seconde. Elle est suivie de la dissociation de l’acide hypochloreux.

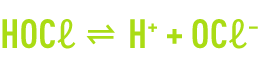
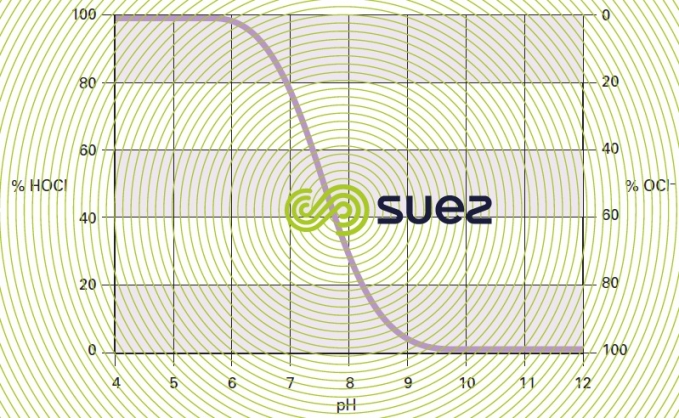
La dissolution du chlore dans l’eau conduit donc à la formation d’acide hypochloreux et d’anion hypochlorite en proportions variables selon le pH et la température du milieu. À 15 °C, les concentrations relatives des deux espèces évoluent en fonction du pH comme représenté à la figure 92.


Le chlore peut être introduit dans l’eau sous forme chlore gazeux ou hypochlorite (sel de sodium en solution (eau de Javel) ou de calcium en poudre). Le pH du milieu détermine alors la nature des espèces présentes. Les concentrations utilisées en pratique sont :
- la teneur en chlore libre, somme des concentrations en acide hypochloreux et hypochlorite déterminées par analyse ;
- la teneur en chlore libre actif présent sous la forme acide hypochloreux (déduite de celle en chlore libre à l’aide de courbes comme celle représentée à la figure 92) ;
- le degré chlorométrique d’une solution d’hypochlorite, représentant la concentration d’une solution qui dégage un litre de chlore gazeux en conditions normales de température et de pression par addition d’acide chlorhydrique : 1° chlorométrique équivaut à 3,17 g · L–1 de chlore actif ;
- la teneur en chlore actif exprime la concentration équivalente en chlore libre d’hypochlorite : 1 g d’hypochlorite de sodium équivaut à 0,95 g de chlore actif.
Le chlore réagit avec de nombreuses substances sous forme acide hypochloreux et/ou ion hypochlorite selon le pH du milieu.
action sur l’azote ammoniacal

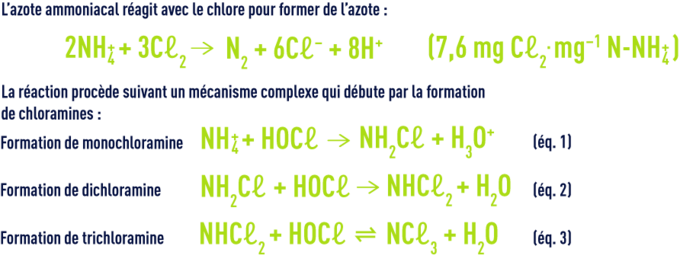
L’ensemble des chloramines inorganiques et organiques constitue le chlore dit combiné par opposition au chlore libre. La libération d’azote a lieu à taux de chloration élevé. Elle résulte des réactions ultérieures (hydrolyse, recombinaison, oxydation par le chlore) à partir de la mono- et de la dichloramine. À pH neutre, la monochoramine est l’entité majoritaire tant que le rapport molaire HOCℓ/NH4+ est inférieur à l’unité.

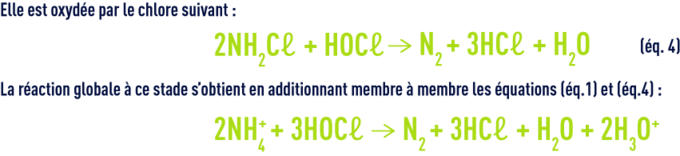
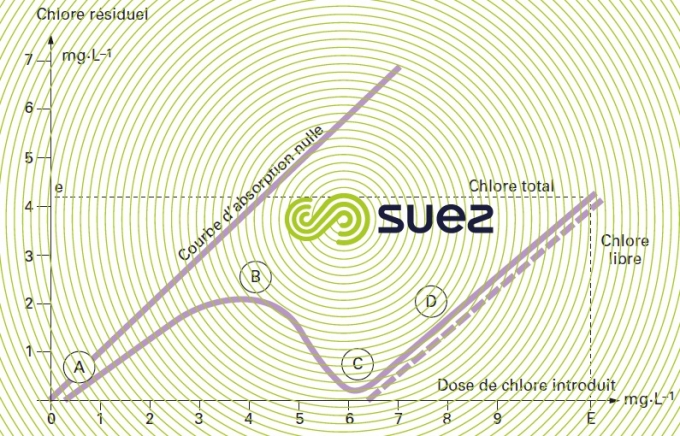
La dose de chlore introduite correspondant à la dose stœchiométrique est appelée point de rupture, point critique ou break-point. Sur la courbe d’absorption du chlore (figure 93), le point de rupture C marque la transformation complète (B à C) des chloramines formées (A à B) et le début d’apparition de chlore libre (D). En chloration d’une eau naturelle, la courbe d’absorption se trouve décalée vers la droite : la présence de matières organiques entraîne une consommation immédiate de chlore qui déplace le point de rupture au- delà de 10 mg · mg–1 d’azote ammoniacal.


action sur les autres composés inorganiques
La chloration peut générer des composés réputés nuisibles et réglementés à partir de polluants inorganiques (chloramines, ion bromate). La présence dans les eaux chlorées de ces produits secondaires dépend principalement du pH du milieu, de la dose de chlore appliquée et du temps de réaction.



action sur les composés organiques
L’action du chlore sur les polluants organiques est relativement sélective. Sa réactivité porte sur des sites d’attaque privilégiés (réducteurs, insaturés, nucléophiles) et entraîne des modifications de structure avec formation de composés plus oxydés et/ou substitués (organochlorés). Il en résulte que la chloration des eaux en vue de la production d’eau de consommation peut produire des composés gênants du point de vue goût et odeur (aldéhydes, chlorophénols), toxiques (trihalométhanes) et/ou potentiellement cancérigènes (organohalogénés) (voir pollution induite par les traitements). Comme dans le cas des composés inorganiques, la présence dans les eaux chlorées de ces produits secondaires dépend du pH du milieu, de la dose de chlore appliquée et du temps de réaction. Ces sous-produits indésirables se forment surtout en présence de chlore libre, donc pour un taux de traitement supérieur au point critique.



action sur les organismes pathogènes
Le chlore particulièrement sous sa forme acide hypochloreux est un biocide puissant. Pour une bonne désinfection, il est donc nécessaire de dépasser le point critique. L’efficacité du chlore en tant que bactéricide est reconnue de même que son action virulicide notable pour l’inactivation des entérovirus pathogènes. En revanche, son effet sur les organismes parasitaires notamment enkystés est négligeable (voir chap. 17 § 2.Oxydation et désinfection par le chlore).
L’action du chlore sur l’azote ammoniacal peut être mise à profit pour générer des chloramines qui présentent un effet bactériostatique du fait de leur forte rémanence. Elles peuvent être formées par chloration d’une eau contenant des ions ammonium en dessous du point de rupture ou par injection simultanée de chlore et de sels d’ammonium ou d’ammoniac dans un rapport massique Cℓ2/N-NH4+ variant de 2 à 4.
le dioxyde de chlore
Le dioxyde de chlore est un composé du chlore au degré d’oxydation + IV. La molécule de dioxyde de chlore possède un électron apparié et est considérée comme un radical relativement stable.



Le dioxyde de chlore est très soluble dans l’eau. Sa solubilité dépend de la température et de la pression. Sa dissolution dans l’eau à pH neutre conduit à un mélange des acides chloreux et chlorique.


En milieu basique, le dioxyde de chlore subit une dismutation en ions chlorite et chlorate. La réaction est irréversible à pH supérieur à 11.

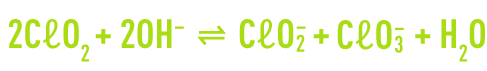
En milieu neutre ou acide, le dioxyde de chlore réagit lentement pour former l’acide chlorique.


Le dioxyde de chlore réagit plus rapidement que le chlore avec le fer et le manganèse dissous. Il est également capable d’oxyder les sulfures, nitrites et cyanures. En revanche, il n’oxyde pas les bromures (sauf avec exposition simultanée à la lumière), ni l’ammoniaque.
Par ailleurs, le chlore présent dans l’eau sous forme acide hypochloreux oxyde le dioxyde de chlore et l’ion chlorite en chlorates.

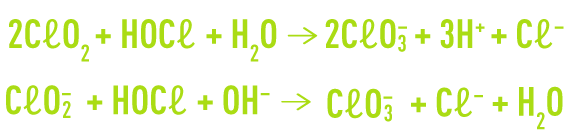



Par rapport aux polluants organiques, le dioxyde de chlore présente à la fois une réactivité différente du chlore et un spectre d’action plus réduit :
- il réagit rapidement avec les dérivés du phénol, avec les amines tertiaires et secondaires, avec les composés organosoufrés ;
- il est quasiment inerte vis-à-vis des composés insaturés autres que phénoliques, des produits oxygénés, des amines primaires (aminoacides).
Les produits organiques issus du traitement de l’eau avec le dioxyde de chlore sont principalement des acides carboxyliques, du glyoxal, des aldéhydes, des cétones et éventuellement des polymères. Au cours du traitement, le dioxyde de chlore est majoritairement transformé en ion chlorite alors que le dioxyde de chlore résiduel évolue en ions chlorate et chlorure. Or les chlorites sont toxiques au même titre que les nitrites (formation de méthémoglobine). C’est pourquoi la concentration totale en dioxyde de chlore, chlorite et chlorate dans l’eau de destinée à la consommation humaine est réglementée dans de nombreux pays et limite les doses employables.
Comparé à l’application du chlore en traitement d’eau destinée à la consommation humaine, le dioxyde de chlore présente l’avantage majeur de ne former ni THM, ni composés organohalogénés (TOX). En pratique, l’excès de chlore utilisé au cours de la génération du dioxyde de chlore donne quand même une faible production de TOX. C’est le réactif de choix pour l’élimination des phénols, responsables de problèmes de goût et d’odeur ; toutefois, l’emploi d’une dose de réactif insuffisante peut conduire à la formation de sous- produits organochlorés au goût médicinal.
Le dioxyde de chlore est un biocide plus efficace que le chlore. Il détruit les virus, les bactéries et les spores ainsi que les biofilms dans les canalisations.
l’ozone
L’ozone est un gaz naturellement présent dans la stratosphère sous l’action de rayonnement ultraviolet émis par le soleil sur les molécules d’oxygène. Il constitue ainsi une protection contre le rayonnement UV nuisible.
Comme sa formule chimique O3 l’indique, l’ozone est composé de trois atomes d’oxygène.



L’ozone est peu soluble dans l’eau. Sa solubilité diminue lorsque la température augmente ou lorsque la concentration de l’ozone dans le gaz décroît (voir constantes caractéristiques des gaz).
La décomposition de l’ozone dans l’eau fait intervenir un mécanisme complexe de réactions en chaîne sous l’effet de divers solutés présents dans l’eau ou libérés au cours du traitement. Ce mécanisme est :
- initié par l’ion hydroxyde (pH élevé), le peroxyde d’hydrogène (formé au cours de l’oxydation de composés organiques), le fer ferreux, les acides formique et glyoxylique, les substances humiques ;
- propagé par des promoteurs tels que les composés à groupement aryle, les acides formique et glyoxylique, les alcools primaires et secondaires, les substances humiques ;
- et terminé par des inhibiteurs qui consomment le radical hydroxyle : ions carbonate et bicarbonate, ion phosphate à forte concentration, acide acétique, alcools tertiaires, composés organiques à groupement alkyle, substances humiques.
Le temps de vie de l’ozone dissous est donc fonction de tous les paramètres ci-dessus décrits.
La chimie de l’ozone dans l’eau est gouvernée par deux types de réaction : soit il peut agir directement sous saforme moléculaire, soit il peut être décomposé par différents mécanismes, conduisant à la formation du radicalhydroxyle OH°, agent oxydant plus puissant que l’ozone lui-même (E° = 2,80 V).
L’oxydation d’un substrat M peut avoir lieu simultanément selon les deux voies réactionnelles schématisées sur la figure 94. Cependant, en pratique, l’action d’une des espèces oxydantes – radical hydroxyle ou ozone – prédomine en fonction des conditions du milieu (pH principalement), de la vitesse avec laquelle l’ozone réagit avec les composés présents, de la nature des produits formés (éventuellement capables d’accélérer ou de retarder la décomposition de l’ozone).

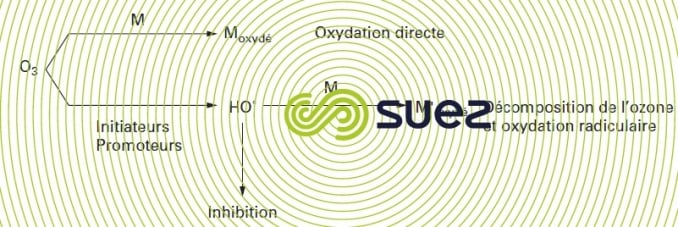

La différence de réactivité de l’ozone avec les composés organiques permet de définir trois classes de composés :
- les composés aromatiques et les aliphatiques insaturés sont facilement oxydés ;
- les composés oxygénés et halogénés saturés et insaturés sont faiblement dégradés ;
- les composés sans liaison C-H comme le tétrachlorométhane ou le pentachlorophénol sont totalement inertes.






L’ozone est le plus puissant désinfectant chimique utilisé en traitement d’eau. De plus, son action sur les agents pathogènes ne dépend pas du pH. En revanche, sa faible stabilité dans le milieu rend obligatoire l’utilisation secondaire d’un oxydant rémanent pour assurer la sécurité dans le réseau de distribution. L’aptitude de l’ozone à inactiver les cellules vivantes peut être étendue jusqu’à provoquer leur lyse. Cette propriété est exploitée dans le cadre du traitement Biolysis O (voir réduction de production de boues).
le permanganate
Le permanganate est un dérivé oxygéné du manganèse au degré d’oxydation + VII. Il est anionique et utilisé sous forme de sel de potassium de formule KMnO4.



Ce composé est d’autant plus soluble dans l’eau que la température est élevée. Dans le domaine du traitement d’eaux naturelles, il donne lieu à deux réactions principales selon le pH du milieu.
en milieu acide

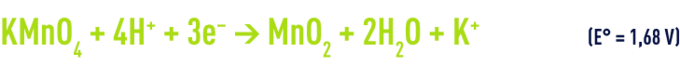
en milieu neutre ou alcalin

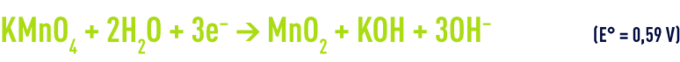
La réduction du permanganate produit du dioxyde de manganèse insoluble à pH supérieur à 3,5. Il s’ensuit qu’une séparation ultérieure du dioxyde précipité est nécessaire dans un étage de coagulation-décantation ou de filtration.
La réactivité du permanganate vis-à-vis des polluants contenus dans les eaux dépend fortement du pH. Il est en pratique recommandé de travailler entre pH 6 et 8,5. Dans ces conditions, les polluants inorganiques affectés par le permanganate sont essentiellement le fer et le manganèse dissous. L’oxydation des sulfures et des cyanures est également possible. En revanche, l’azote ammoniacal n’est quasiment pas transformé de même que les ions bromures.




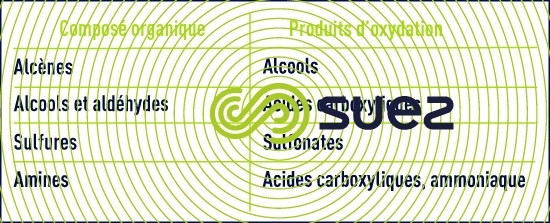

L’oxydation des composés organiques par le permanganate fait intervenir des mécanismes complexes. L’ordre de réactivité s’établit comme suit :
- les composés soufrés, les amines primaires et les aldéhydes réagissent rapidement ;
- les cétones et les composés aromatiques sont lentement convertis.
L’utilisation de permanganate ne donne pas lieu à la formation de trihalométhanes.
Enfin, il est reconnu que l’action du permanganate n’est pas suffisante pour la désinfection complète des eaux à potabiliser. Une post-désinfection est alors nécessaire.
le peroxyde d’hydrogène
Le peroxyde d’hydrogène communément appelé eau oxygénée a pour formule chimique H2O2.



Le peroxyde d’hydrogène est un composé métastable. Il se décompose facilement en oxygène selon un processus exothermique.

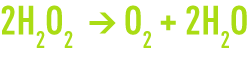
La décomposition se produit sous l’effet de nombreuses substances poreuses (telles que la pierre ponce, la mousse de platine, le dioxyde de manganèse) ou de substances dissoutes (comme les ions hydroxydes et certains métaux). Elle est plus ou moins violente selon la concentration de la solution en peroxyde.
Le peroxyde d’hydrogène est disponible en solution aqueuse de 30 % à 70 % en masse. La concentration des solutions est souvent exprimée en volume correspondant au volume d’oxygène qui peut être libéré par litre de solution et mesuré dans les conditions normales de température et de pression (0 °C et 101,325 kPa). La conversion du pourcentage massique en volume s’effectue selon :
- volume = 3,67 × % massique (exemple 30 % en masse égale 110 volumes).
La réactivité du peroxyde d’hydrogène dans l’eau est liée à son caractère acide faible et à son pouvoir oxydant et réducteur.

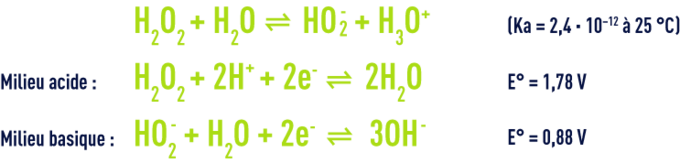
Au pH des eaux naturelles, le peroxyde d’hydrogène est présent dans l’eau sous forme moléculaire. Il est capable de réagir avec les polluants comme récapitulé dans le tableau 37.



Le peroxyde d’hydrogène reste peu employé en traitement des eaux. Son application est réservée à quelques actions spécifiques qui visent principalement l’élimination des sulfures et des cyanures.
De même, ses propriétés bactéricide et algicide ne sont exploitées en traitement d’eau que dans quelques cas relatifs aux eaux de piscine ou aux eaux de circuits industriels.
l’acide peracétique
L’acide peracétique également appelé acide peroxyacétique ou acide éthaneperoxoïque appartient comme le peroxyde d’hydrogène à la famille des composés peroxydes caractérisés par la présence de deux atomes d’oxygène adjacents (-O-O-, groupement « peroxy »). Sa formule chimique s’écrit CH3COOOH.
L’acide peracétique est un liquide incolore, d’odeur piquante et miscible à l’eau en toutes proportions. Ce composé est instable et n’existe pas à l’état pur. Il est disponible en solution aqueuse en mélange avec l’acide acétique et le peroxyde d’hydrogène selon l’équilibre :

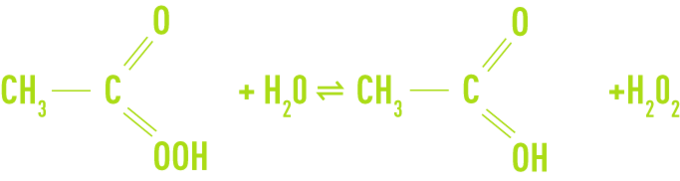
En plus de l’acide peracétique, de l’acide acétique, du peroxyde d’hydrogène et de l’eau, les solutions commerciales contiennent des stabilisants de type acide (acide sulfurique), chélatant et séquestrant. Les solutions les plus concentrées renferment 40 % d’acide peracétique, 40 % d’acide acétique, 5 % de peroxyde d’hydrogène et 13 % d’eau.



L’acide peracétique en solution aqueuse est moins stable que le peroxyde d’hydrogène. Il se décompose spontanément en acide acétique et oxygène. La réaction est accélérée par la chaleur (explosion par chauffage à 110 °C) et en présence d’ions métalliques (fer, cuivre, manganèse, nickel, chrome…).


L’acide peracétique est un agent oxydant fort capable de réagir avec de nombreux composés inorganiques et organiques. Ses propriétés oxydantes sont principalement utilisées :
- en synthèse chimique (initiateur de polymérisation et agent de réticulation) ;
- dans les procédés de blanchiment des fibres textiles et de la pâte à papier ;
- pour la désinfection et la stérilisation dans l’industrie agroalimentaire et en secteur hospitalier.
La réponse des indicateurs (coliformes totaux, E. coli, streptocoques fécaux, spores de Clostridium, bactériophages) à l’action antimicrobienne de l’acide peracétique permet d’envisager son application en désinfection d’eaux résiduaires, surtout en cas de désinfection temporaire (quelques mois par an).
les rayons UV
Les rayons ultraviolets constituent les radiations du spectre électromagnétique de longueurs d’onde comprises entre 100 et 400 nanomètres soit entre le domaine visible et le domaine des rayons X. Le spectre UV est lui-même divisé en quatre domaines de longueur d’onde (figure 95).

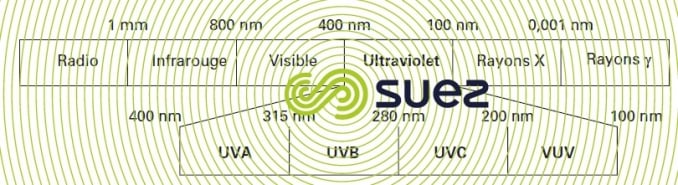

L’ensemble du domaine UV est le siège des ondes dites actiniques ou chimiques du fait que l’énergie des photons émis est capable de produire des transformations chimiques selon un processus photochimique. Le rayonnement utilisé en traitement de désinfection se situe dans la gamme UVC qui définit le domaine germicide. En effet, les constituants des matériaux cellulaires, protéines et acides nucléiques, absorbent la lumière entre 200 et 300 nm avec un maximum d’absorbance à 260 nm pour l’ADN.
Ce rayonnement UV est produit à partir de lampes à gaine de quartz et à vapeur de mercure à faible pression ou à moyenne pression. Selon le cas, l’émission est respectivement quasi-monochromatique à 254 nm ou polychromatique (voir la désinfection par ultraviolets).
Le mécanisme d’action germicide est basé sur l’absorption des photons par les bases pyrimidine de l’ADN, principalement thymine mais aussi cytosine. L’irradiation provoque alors la dimérisation à partir de bases voisines avec rupture de la chaîne ADN de telle sorte que la réplication ultérieure est inhibée (figure 96). L’efficacité du rayonnement UV est prouvée concernant l’élimination des bactéries sous forme sporulée ou non, des rotavirus et poliovirus et des kystes de protozoaires tels que les kystes de Cryptosporidium. En revanche, les œufs d’Helminthe ne seraient pas inactivés.

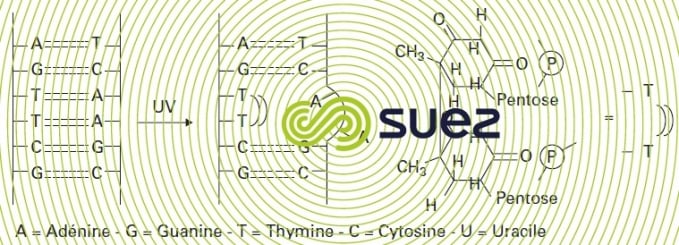

La reviviscence de certains micro-organismes peut limiter la qualité de désinfection. Ce problème est lié au développement de mécanismes capables de régénérer la structure ADN :
- photoréactivation (monomérisation des dimères de pyrimidines) ;
- excision-réparation (remplacement des nucléotides endommagés avec recombinaison des motifs non altérés).
Les études menées montrent que la photoréactivation est possible pour les germes Coliformes totaux et fécaux, Escherichia Coli, Streptomyces, Aerobacter, Penicillium, Saccharomyces et Micrococcus.
Les rayons UV appliqués en traitement de désinfection sont réputés pour leur production minimale de sous-produits. Les composés chimiques présents dans l’eau qui absorbent aux longueurs d’onde émises pour la désinfection peuvent cependant donner lieu à la formation de produits secondaires. Ce phénomène est d’autant plus important que le spectre de lumière propre au système de production UV est large par rapport à la longueur d’onde germicide (cas des lampes moyenne pression).
Il concerne notamment les composés à noyau aromatique et les composés aliphatiques chlorés mais leur photo-oxydation nécessite des doses d’irradiation très élevées, sans rapport avec les conditions d’application usuelles. La formation de composés organiques assimilables et le développement de la mutagénicité sont mis en évidence à très forte dose comme résultant de l’irradiation de composés organiques dissous dans les eaux naturelles qui absorbent la lumière entre 200 et 250 nm.
De la même façon, l’apparition de nitrites par photolyse des nitrates se produit à longueur d’onde inférieure à 240 nm.
les systèmes d’oxydation avancés
Pour augmenter encore les performances de l’oxydation chimique, sont aujourd’hui développés des procédés dits d’oxydation avancée capable de produire des rendements d’oxydation poussés pour les polluants organiques de l’eau. Leur principe commun est de générer directement dans le milieu réactionnel par activation d’un oxydant primaire disponible, un oxydant secondaire plus puissant et moins sélectif. Dans la plupart des cas, l’espèceréactive formée est le radical hydroxyle dont le potentiel standard d’oxydoréduction s’élève à 2,8 V à 25 °C.

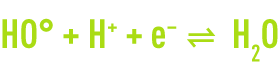
Cet oxydant secondaire est capable de promouvoir l’oxydation de la plupart des composés organiques jusqu’à leur minéralisation complète en dioxyde de carbone et eau. Le radical hydroxyle réagit généralement au moins un million de fois plus vite que l’ozone ou le peroxyde d’hydrogène ce qui doit entraîner des réductions de taille d’installation.
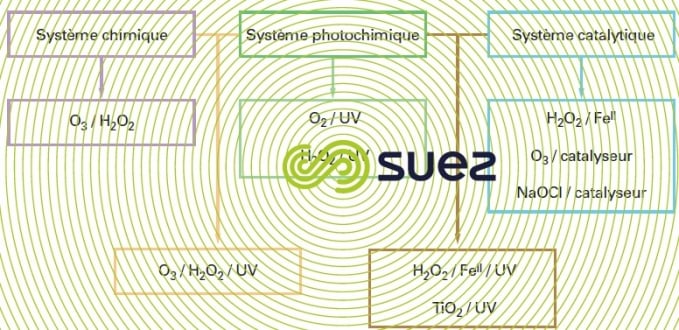
De nombreux procédés d’oxydation avancée existent. Ils sont classés par type d’activation de l’oxydant primaire :
- activation chimique pour les procédés impliquant le couple ozone/peroxyde d’hydrogène,


- activation photochimique pour les procédés basés sur l’irradiation ultraviolette couplée aux oxydants ozone et/ou peroxyde d’hydrogène ou impliquant un photocatalyseur de type semiconducteur tel que le dioxyde de titane,

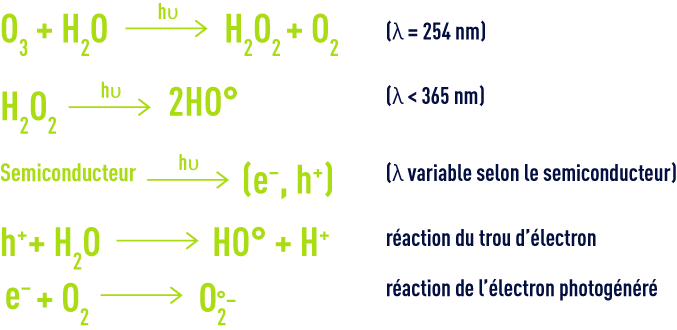
- activation catalytique, avec le procédé le plus anciennement développé représenté par le système de Fenton (fer ferreux/peroxyde d’hydrogène), les procédés d’ozonation catalytique parmi lesquels Toccata (voir ozonation catalytique: toccata) et un procédé catalytique à base d’hypochlorite.


Depuis leur introduction sur le marché dès les années 1970, les installations de procédés d’oxydation avancée n’ont que peu à peu reçu des applications en traitement d’eau Le système combiné O3/H2O2 est le plus exploité notamment pour l’élimination de pesticides en vue de la production d’eau destinée à la consommation humaine. Les procédés qui l’impliquent ne sont plus autorisés en France à cause des sous-produits (bromates et produits d’oxydation des pesticides) dont ils favorisent la formation. Les procédés photochimiques sont plutôt réservés à l’élimination de composés organiques en faibles concentrations pour la réhabilitation d’eaux souterraines par exemple. Les procédés catalytiques quant à eux ont un spectre d’activité qui s’étend jusqu’au traitement des eaux résiduaires industrielles dans les domaines papetiers, textiles, chimiques… (voir ozonation catalytique: toccata).
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












