composition de la matière
Temps de lecture :On appelle corps pur, une substance dont les constantes physiques sont identiques quelle que soit la taille de l’échantillon pris.
La molécule est la plus petite partie d’un corps pur ayant toutes les propriétés physiques et chimiques de celui-ci.
Une molécule peut être dissociée par des moyens chimiques ou physiques. L’énergie mise en œuvre est forte. La molécule est formée d’atomes assemblés par des liaisons chimiques :
- atomes identiques pour un corps pur simple, ou
- atomes différents pour un corps pur composé.
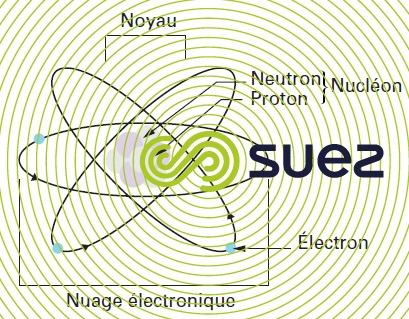
L’atome est la plus petite partie d’un élément chimique qui puisse être conçue. Il est constitué d’un noyau chargé positivement autour duquel gravitent des électrons chargés négativement. Le noyau est lui-même formé de nucléons de deux espèces : les protons et les neutrons (figure 5) :


- l’électron a pour charge électrique


coulomb. Sa masse est de 9,109·10–31 kg. L’électron possède un moment angulaire (spin) par suite de sa rotation autour de son axe ; il en résulte un moment magnétique dipolaire responsable des propriétés de la plupart des substances para et ferromagnétiques ;
- le proton est une particule de charge positive égale à

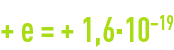
coulomb, dont la masse est 1 835 fois celle de l’électron (1,673·10–27 kg) ;
- le neutron est une particule électriquement neutre de masse égale à 1,001 4 fois celle du proton.
L’atome occupe dans l’espace un volume assimilé à une sphère d’un diamètre de quelques angströms. Sa masse est de l’ordre de 10–26 kg. Le noyau a un diamètre de l’ordre du fermi (10–15 m), soit très petit devant celui de l’atome. Il concentre presque toute la masse de l’atome. Le rayon de l’atome est supérieur à celui du noyau d’un facteur 100 000. L’atome est caractérisé par :
- son numéro atomique Z correspondant au nombre de protons contenus dans le noyau ;
- son numéro de masse atomique A égal à la somme des nombres de protons Z et de neutrons N.
Le nombre d’électrons égal au nombre de protons Z détermine les propriétés de l’atome. Les électrons sont en mouvement très rapide dans le champ d’attraction du noyau. Ils se déplacent sur différentes orbites centrées sur le noyau qui correspondent à plusieurs niveaux d’énergie définis par des nombres quantiques. Ils peuvent passer d’un niveau énergétique à un autre selon des règles par absorption ou émission d’une certaine énergie, multiple entier de l’unité d’énergie appelée quantum ou photon. L’énergie de la transition entre deux niveaux adjacents est égale à hu où h est la constante de Planck (6,626 075 5·10–34 J · s), et où u est la fréquence du photon associé, inversement proportionnelle à sa longueur d’onde l (l = c/u avec c, constante de vitesse de la lumière, 299 792 458 m · s–1).
À l’exception des gaz nobles qui sont monoatomiques, la matière à l’état gaz, liquide ou solide n’est pas formée d’atomes isolés mais d’atomes associés en molécules, en solides métalliques ou ioniques. Ces assemblages résultent de l’établissement de liaisons et d’interactions entre les atomes par le biais des électrons des couches externes pour donner des structures stables.
ions – isotopes
Les ions dérivent des atomes par la perte ou le gain d’électrons sous l’effet d’un apport d’énergie thermique ou électrique. Les éléments électropositifs comme le fer donnent des ions chargés positivement appelés cations. Les éléments électronégatifs comme le chlore et le soufre donnent des ions chargés négativement appelés anions. Un ion peut être formé à partir de plusieurs atomes électriquement chargés (cas du carbonate). Les anions et cations n’existent généralement pas sous forme isolée mais associés entre eux en composés ioniques.
Les isotopes d’un même élément correspondent à des atomes portant le même nombre d’électrons mais différents nombres de neutrons. Des atomes isotopes ont donc les mêmes propriétés chimiques. Seule leur cinématique est différente.
Plusieurs isotopes sont connus pour la plupart des éléments. Pour distinguer les isotopes d’un élément, on les désigne par leur symbole précédé des nombres A et Z :


masse atomique des éléments – mole – masse molaire
La masse des électrons étant négligeable, la masse d’un atome est égale à la masse des nucléons. Ces masses étant très petites, et donc d’emploi peu commode, il a été convenu de définir l’unité de masse atomique (u) comme le 1/12e de la masse d’un atome de carbone 12C (1,66054·10–27 kg) (14e Conférence générale des poids et mesures 1971).
Les Anglo-Saxons et les biochimistes utilisent le dalton (Da) avec 1 u = 1 Da. La masse atomique d’un élément est calculée comme la somme des masses des différents isotopes pondérées de leur abondance relative (par exemple l’élément chlore a pour masse atomique 35,453 u).
Devant le très grand nombre de particules contenues dans un échantillon de matière, les chimistes ont créé l’unité de mesure de la quantité de matière appelée mole (symbole « mol »). La mole est par définition la quantité de matière d’un système contenant autant d’entités élémentaires qu’il y a d’atomes dans 12 g de carbone 12C.
Le nombre d’entités élémentaires dans une mole de substance est de 6,022·1023 (nombre d’Avogadro).
La masse d’une mole de carbone 12C est de 12 g exactement, celle d’une mole d’atome de chlore est de 35,5 g ; la quantité de matière contenue dans 1 kg d’eau H2O est de 55,533 mol.
On définit la masse molaire d’une substance comme étant le quotient de la masse moyenne de ce corps par la quantité de matière qu’il contient : elle s’exprime en gramme par mole (g·mol–1). La masse molaire d’une molécule comportant plusieurs atomes est usuellement calculée selon :

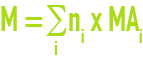
où ni est le nombre d’atomes i de masse atomique MAi.
classification des éléments – formule des composés
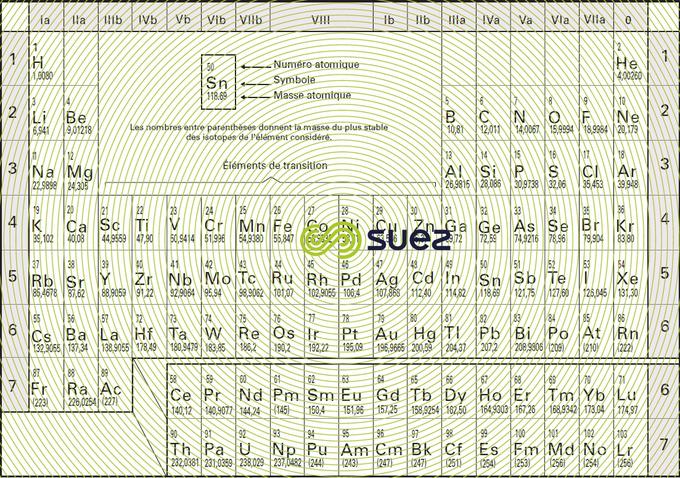
Les propriétés des éléments chimiques ne sont pas quelconques, mais dépendent de la structure électronique de l’atome : deux atomes différents ayant leurs couches périphériques identiques ont des propriétés chimiques voisines (familles des alcalins, des halogènes…). La classification périodique des éléments dérivée du tableau de Mendeleïev (figure 6), rend compte de ces analogies. Chaque élément y est représenté par un symbole et un numéro atomique. La masse atomique moyenne de chacun est mentionnée en bas et à droite dans la case correspondante.


Les substances chimiques sont représentées par des formules obtenues à partir des symboles des éléments qui les constituent. Chaque symbole est affecté d’un indice indiquant le nombre d’atomes correspondant. La molécule d’eau H2O contient 2 atomes d’hydrogène et 1 atome d’oxygène.
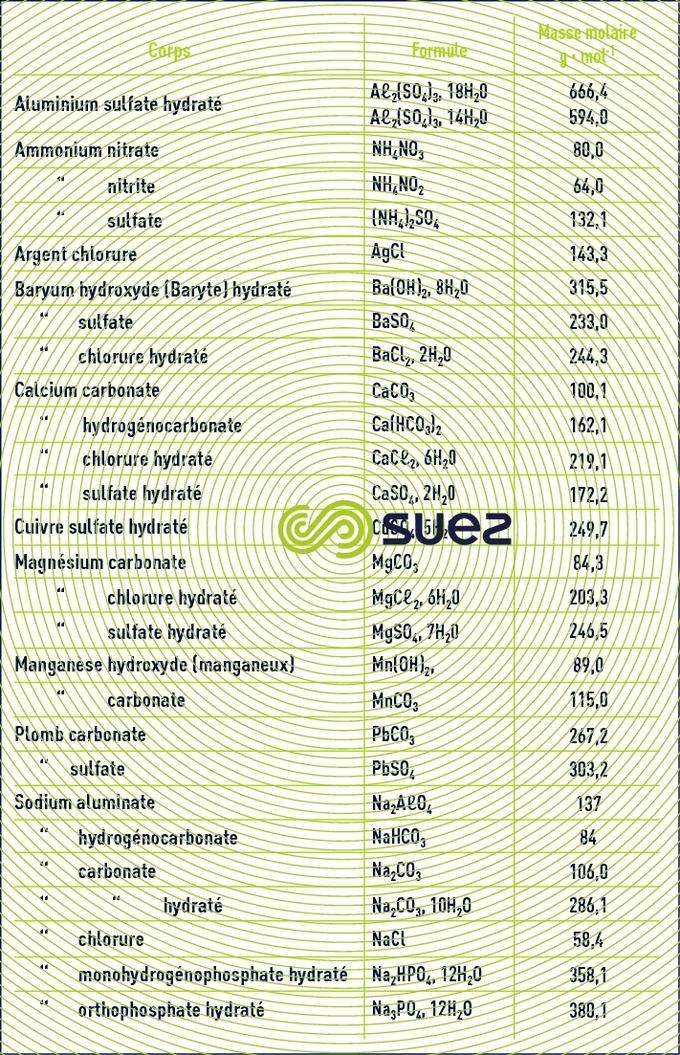
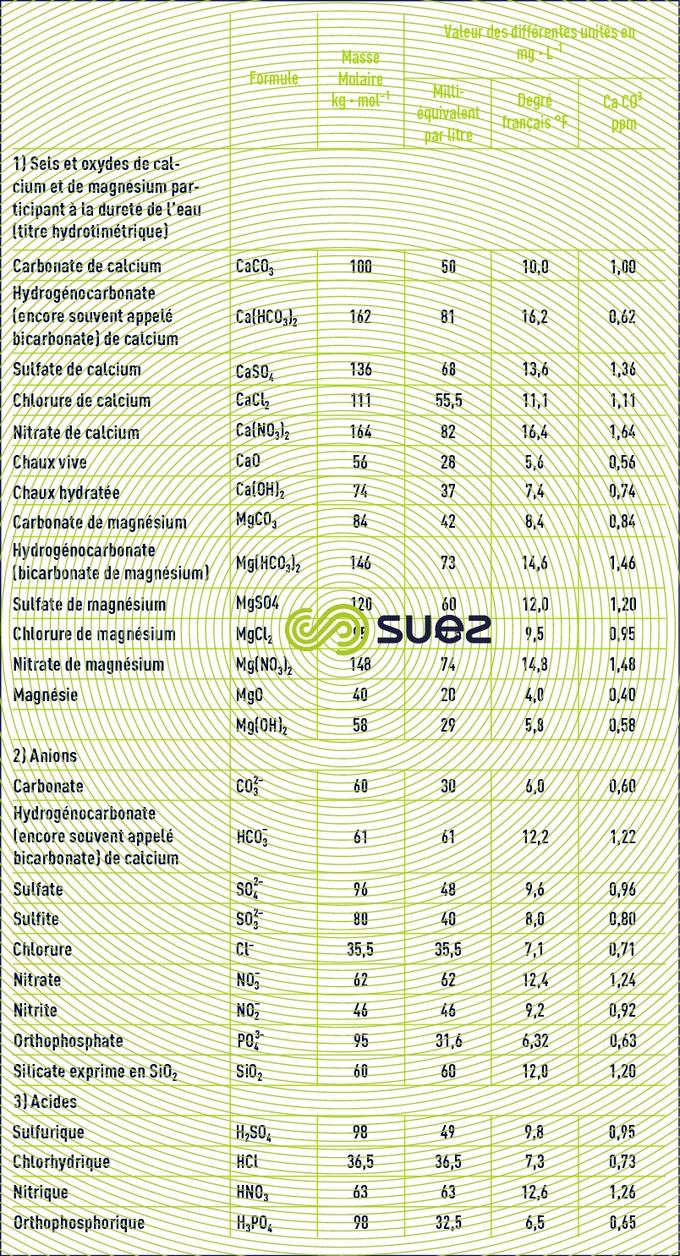
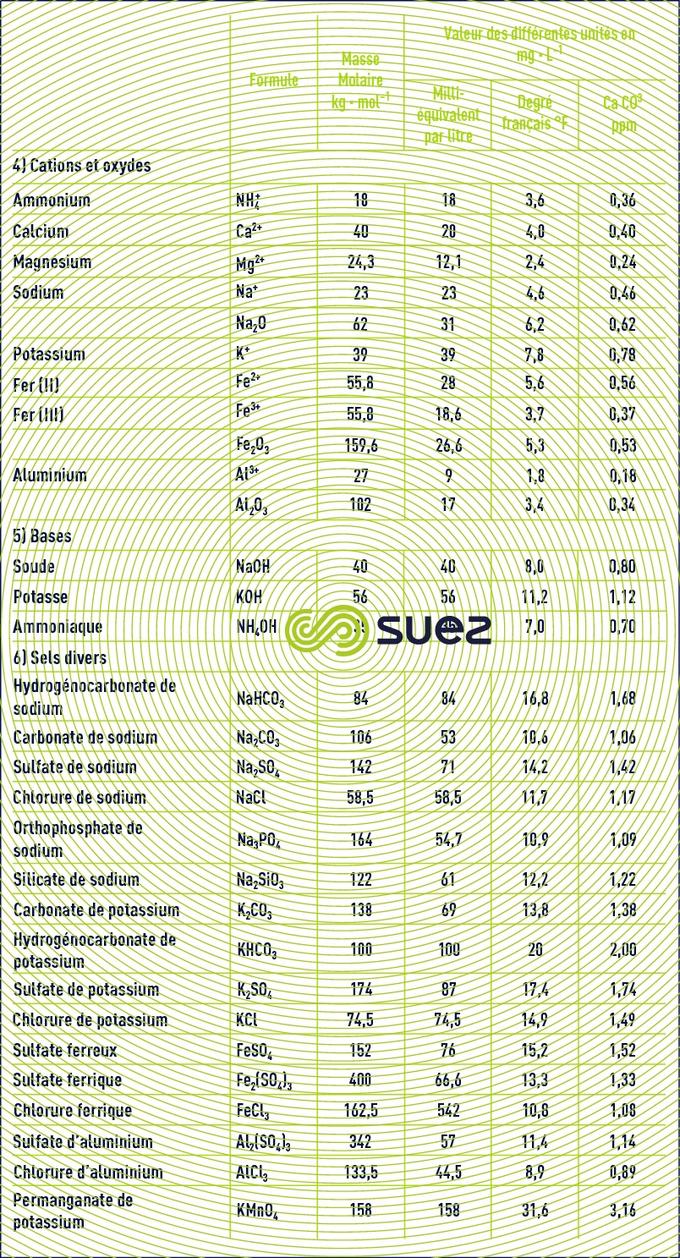
Le tableau 22 donne la formule et la masse molaire des principaux sels utilisés en traitement des eaux.
Pour les corps organiques, on utilise souvent une formule dite semi-développée qui indique la présence de certains groupements fonctionnels dans la molécule. Ainsi, on écrit l’acide acétique CH3COOH pour montrer qu’il y a un groupe CH3 lié par un atome de carbone au groupement carboxylique COOH.


règles pour la dénomination des composés et l’écriture des formules
La dénomination des composés organiques est effectuée selon la nomenclature de l’Union internationale de chimie pure et appliquée (IUPAC). Toutefois, de nombreux noms d’usage existent et sont quotidiennement utilisés.
Les recherches dans les divers catalogues ou dictionnaires chimiques sont à effectuer à partir de la formule brute.
Les règles complètes concernant la Nomenclature de chimie inorganique ont été publiées par la Société chimique de France (février 1975). Quelques paragraphes fondamentaux en sont rappelés ci-après :
- (dans les formules, le constituant électropositif (cation) doit toujours être placé le premier, exemple KCℓ, CaSO4. Si le composé contient plus d’un constituant électropositif ou électronégatif, la séquence à l’intérieur de chaque classe devrait être celle de l’ordre alphabétique des symboles. Les acides sont traités comme des sels d’hydrogène, par exemple H2SO4 et H2PtCℓ6 ; pour la place de l’hydrogène, voir combinaisons de lettres.
- dans le cas de composés binaires entre éléments non métalliques, le constituant à placer en tête est celui qui figure le premier dans la liste suivante : B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cℓ, O, F. Exemple : NH3, H2S, SO2, C,O2, OF2.
- sels contenant des atomes d’hydrogène acide. Les noms de ces sels se forment en ajoutant le préfixe hydrogéno au nom de l’anion pour indiquer la présence dans ce sel de l’hydrogène substituable. De tels sels ne peuvent naturellement pas être appelés des sels acides. Exemples :
- NaHCO3 : hydrogénocarbonate de sodium ;
- LiH2PO4 : dihydrogénophosphate de lithium ;
- KHS : hydrogénosulfure de potassium.
- sels doubles, triples.
- cations : dans les formules, tous les cations doivent précéder les anions.
- les cations autres que l’hydrogène doivent être cités par ordre alphabétique, ordre qui peut être différent dans les formules et dans les noms. Exemple : KNaCO3 : carbonate de potassium et de sodium
- hydrogène acide : l’hydrogène est écrit le dernier parmi les cations lorsque la règle 6.2 n’est pas appliquée. Exemple : NaNH4HPO4, 4H20 : hydrogénophosphate d’ammonium et de sodium à 4 molécules d’eau.
- anions : les anions doivent être écrits par ordre alphabétique, ordre qui peut être différent dans les formules et dans les noms.
évaluation des concentrations
emploi du milliéquivalent
Pour faciliter les calculs, on a pris l’habitude d’évaluer les résultats des analyses non pas en grammes par litre mais en équivalent gramme par litre. Le sous-multiple est le milliéquivalent par litre (meq · L–1).
Par exemple, la masse atomique du chlore étant de 35,5 g, si une eau contient 2 g de chlorure par litre, on peut exprimer ce résultat en écrivant qu’elle contient :

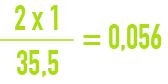
équivalent-gramme de chlorure par (56 meq · L–1).
S’il s’agit d’un élément polyvalent, l’unité de concentration « meq · L–1 » a pour valeur, exprimée en mg · L–1, la masse molaire divisée par la valence. Par exemple, pour le calcium, élément bivalent dont la masse molaire est 40 g, une concentration d’1 meq · L–1 correspond à :

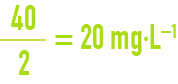
L’avantage de cette notation est de permettre le calcul immédiat des concentrations salines. Si, dans l’exemple précédent d’une eau contenant 56 milliéquivalents de chlorure par litre, il s’agit d’une solution pure de chlorure de calcium, la concentration en CaCℓ2 est :

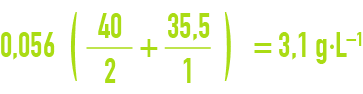
et la dose de calcium correspondante de :

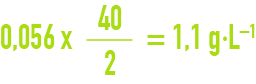
On a très souvent besoin de connaître non pas le détail des différents sels dissous, mais le bilan des anions et des cations. La notation en équivalent permet immédiatement d’avoir une idée de ce bilan.
emploi des degrés (tableau 23)
La notion d’équivalent et de milliéquivalent a l’avantage d’être internationale, mais l’emploi en France du degré demeure fréquent (1 °F = 0,2 milliéquivalent par litre) ainsi que celui de la ppm de CaCO3 (1 ppm CaCO3 = 0,02 milliéquivalent par litre) en Angleterre et aux États-Unis, ou du degré Allemand (1°dh = 1,786 °F ou 0,3572 milliéquivalent par litre).




Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












