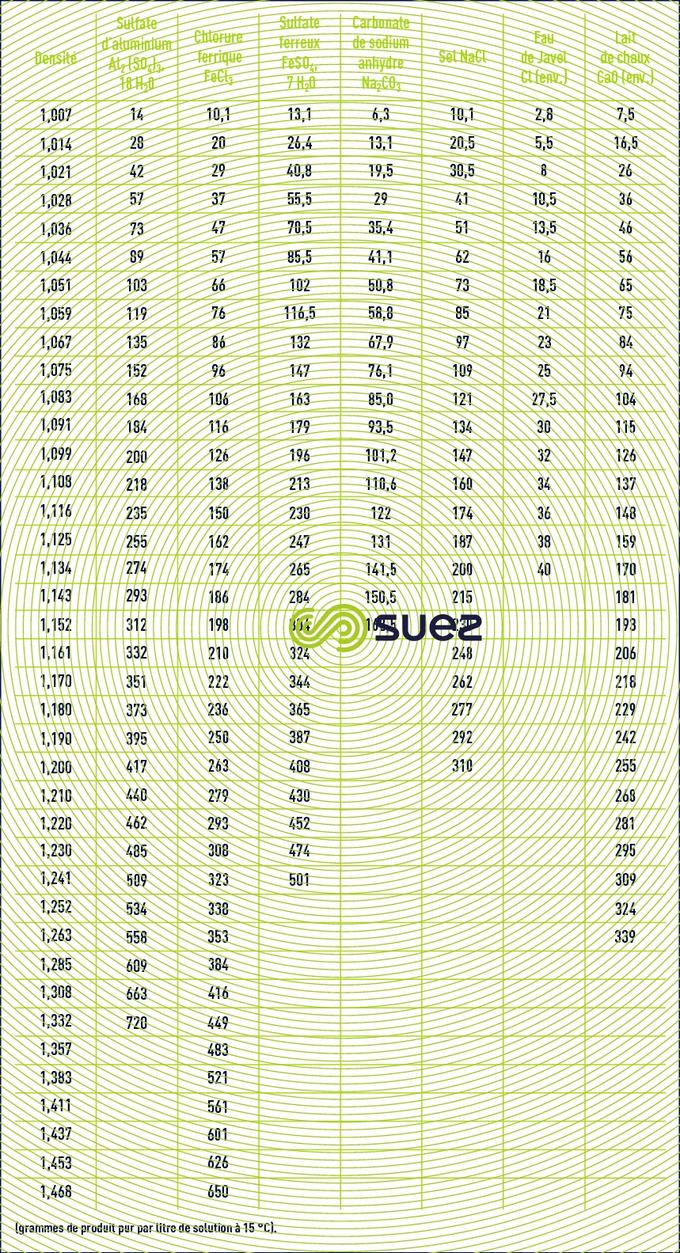
constantes caractéristiques de solution
Temps de lecture :densités

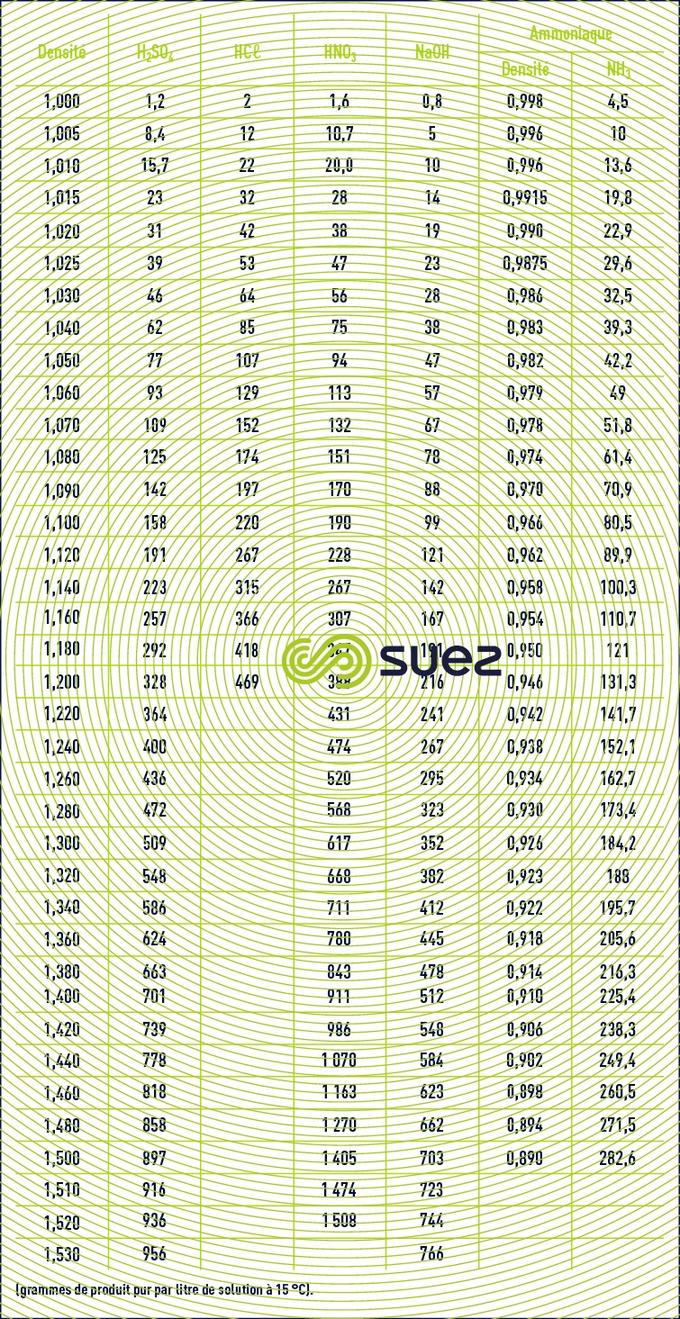



Remarque : l’eau de Javel, nom commercial de l’hypochlorite de sodium, est caractérisée par sa teneur en chlore actif qui s’évalue en degré chlorométrique. 1° chlorométrique = 3,17 g de chlore actif par litre. 1 L d’eau de Javel à 18° Cℓ contient 57 g de Cℓ2 actif. 1 L d’eau de Javel à 48° Cℓ contient 152 g de Cℓ2 actif.
conductivité – résistivité
La conductivité est mesurée par la conductance d’une colonne d’eau comprise entre deux électrodes métalliques de 1 cm2 de surface, séparées l’une de l’autre de 1 cm. Elle augmente avec la teneur en sels dissous et varie en fonction de la température (figure 7). La conductivité est exprimée en siemens par mètre (S·m–1). Le sous-multiple microsiemens par cm (μS·cm–1) est l’unité la plus utilisée en traitement d’eau.

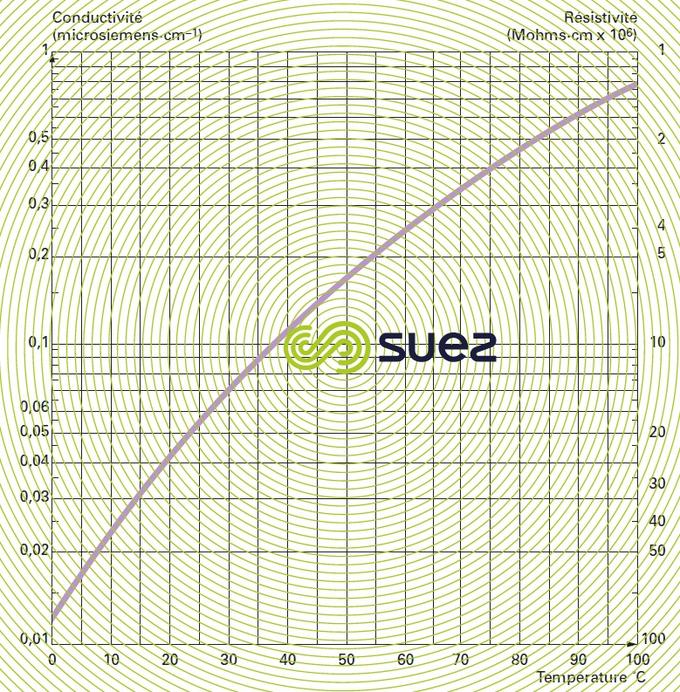

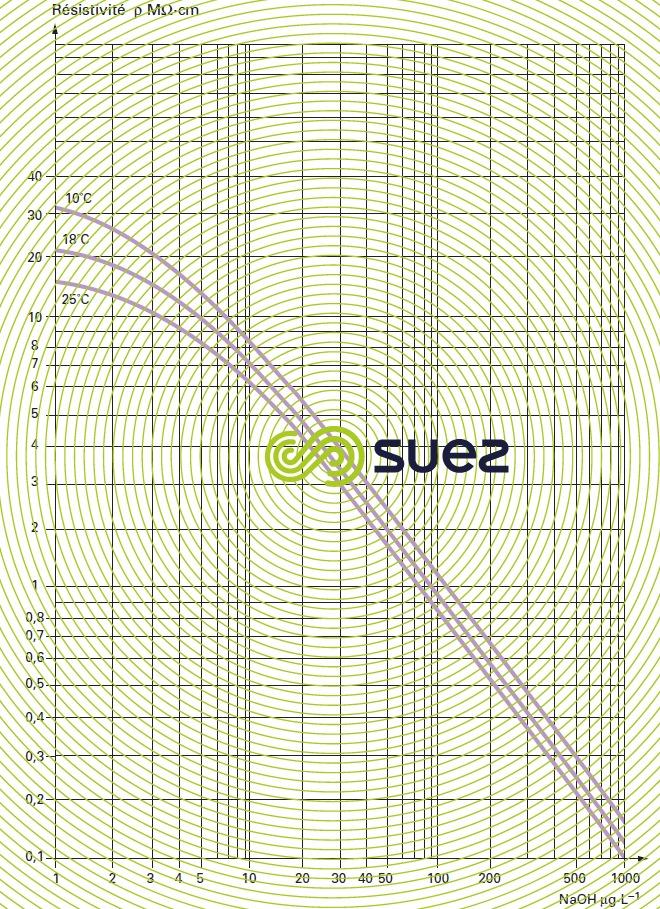
La résistivité est l’inverse de la conductivité et est mesurée en ohms·cm (Ω·cm). La relation entre les deux mesures est la suivante :

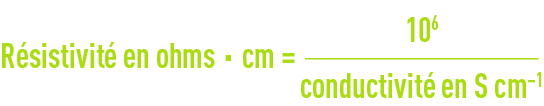
Exemple : une conductivité de 10 μS.cm-1 correspond à une résistivité de 100 000 ohms.cm.
étalonnage des résistivimètres
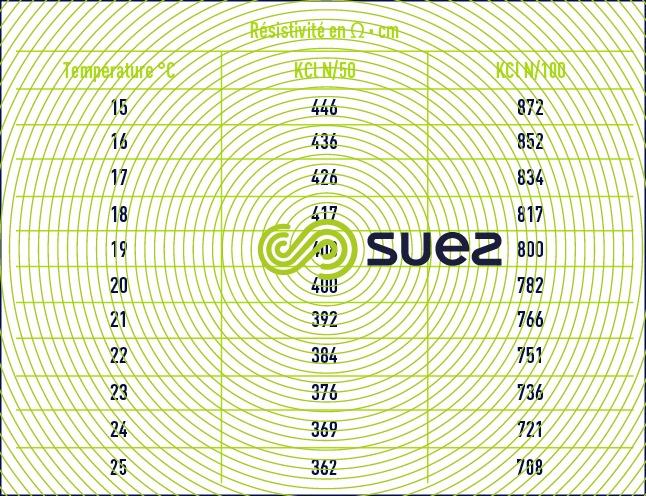
Les cellules de mesure de résistivité doivent être réétalonnées périodiquement avec des solutions N/50 ou N/100 de chlorure de potassium (tableau 26) :

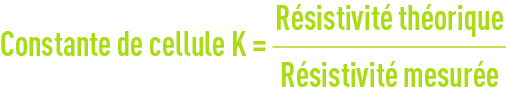


relation avec les sels dissous
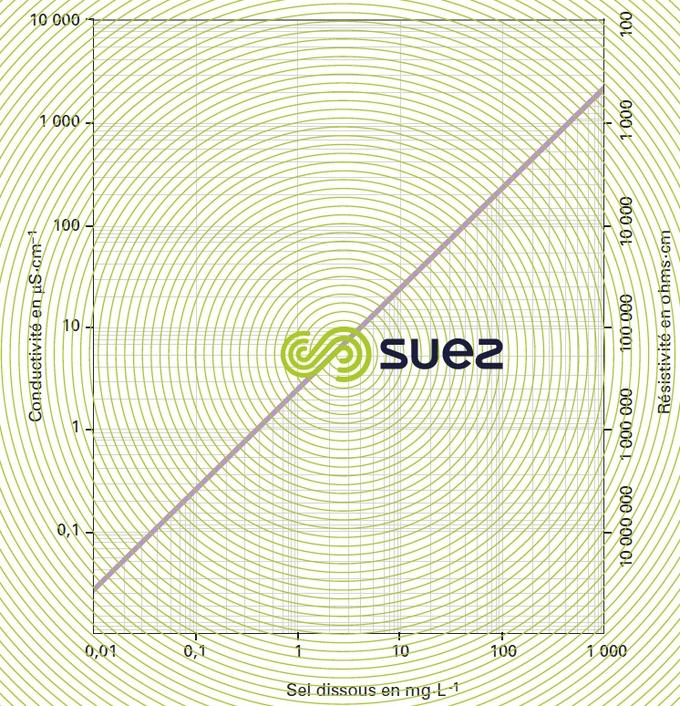
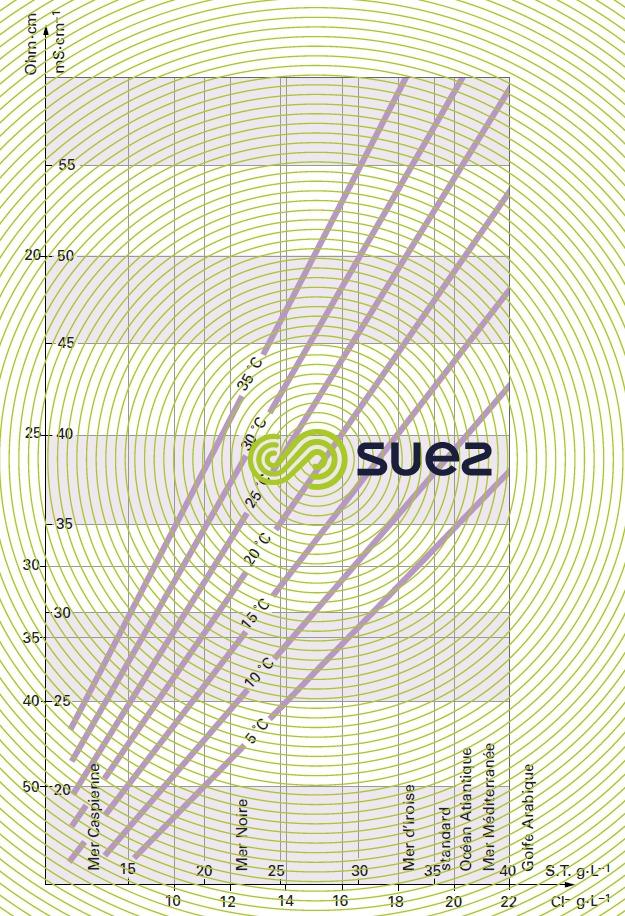
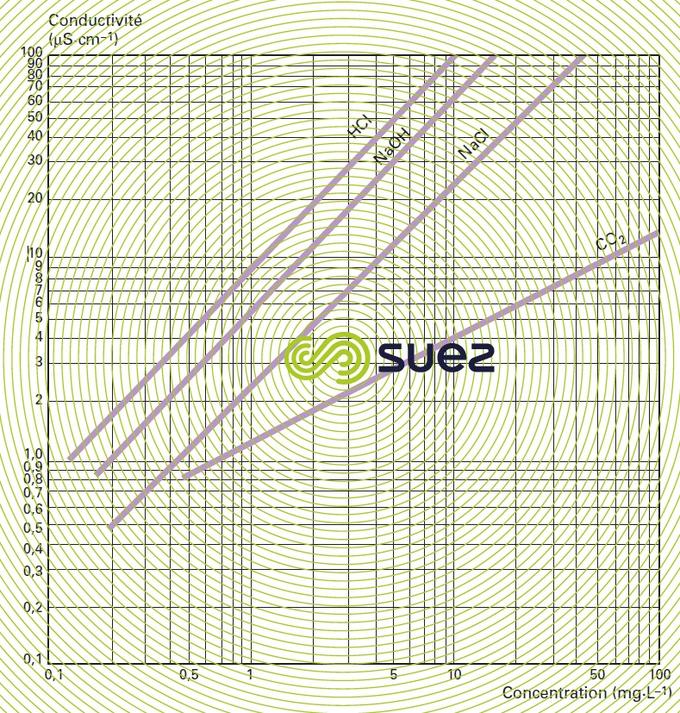
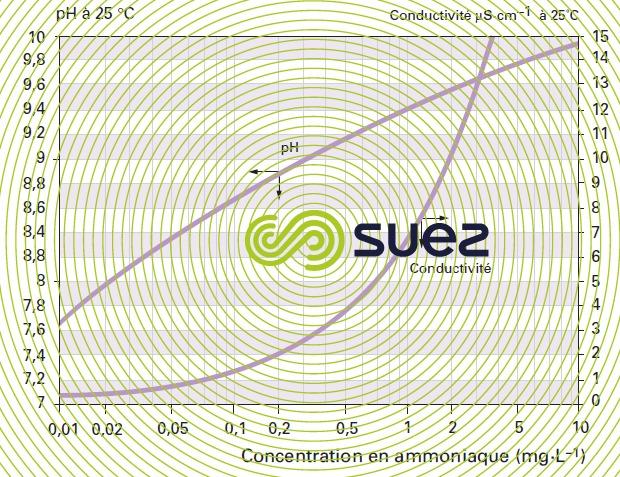
Pour chaque type de sels dissous, il existe une relation empirique entre la conductivité et la concentration en sel ; par exemple, pour une variation de concentration de 1 mg · L–1 en solution diluée, la conductivité à 25 °C peut varier entre 1,25 μS · cm–1 pour une solution pure d’hydrogénocarbonate de calcium et 2,5 μS · cm–1 pour une solution pure de chlorure de sodium (dissocié en ions très mobiles, figure 8), en passant par 1,5 à 1,6 μS · cm–1 pour une eau douce naturelle où tous les sels les plus courants sont représentés ; ce principe se vérifie également dans l’eau de mer (figure 9). Le rapport entre conductivité et concentration est encore plus élevé dans une solution pure d’acide ou de base (figure 10).


La mesure d’une variation de conductivité (ou de résistivité) donne donc des informations précises sur l’évolution de la salinité d’une eau, même à de très faibles concentrations (figure 11). D’autre part, les eaux naturelles peuvent être classées en fonction de leur conductivité (ex. : faiblement minéralisées à moins de 200 μS · cm–1, moyennement minéralisées entre 200 et 600 μS · cm–1, fortement minéralisées à plus de 600 μS · cm–1).






viscosité des liquides

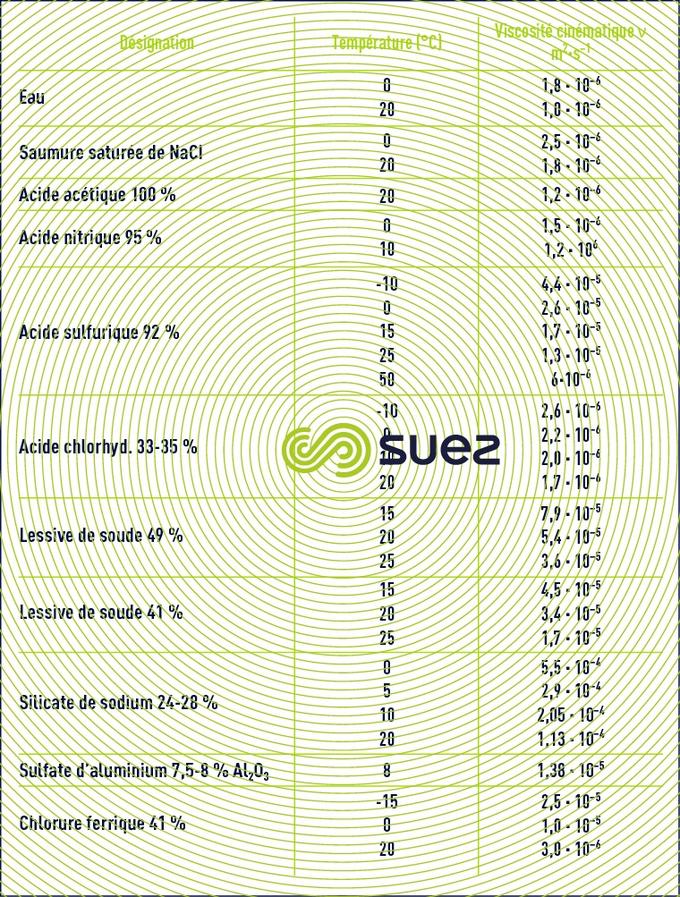

Remarque : certains adjuvants de floculation ont une viscosité élevée à faire préciser par le fournisseur (voir principaux réactifs utilisés en traitement d'eau).



solutions remarquables
solubilités




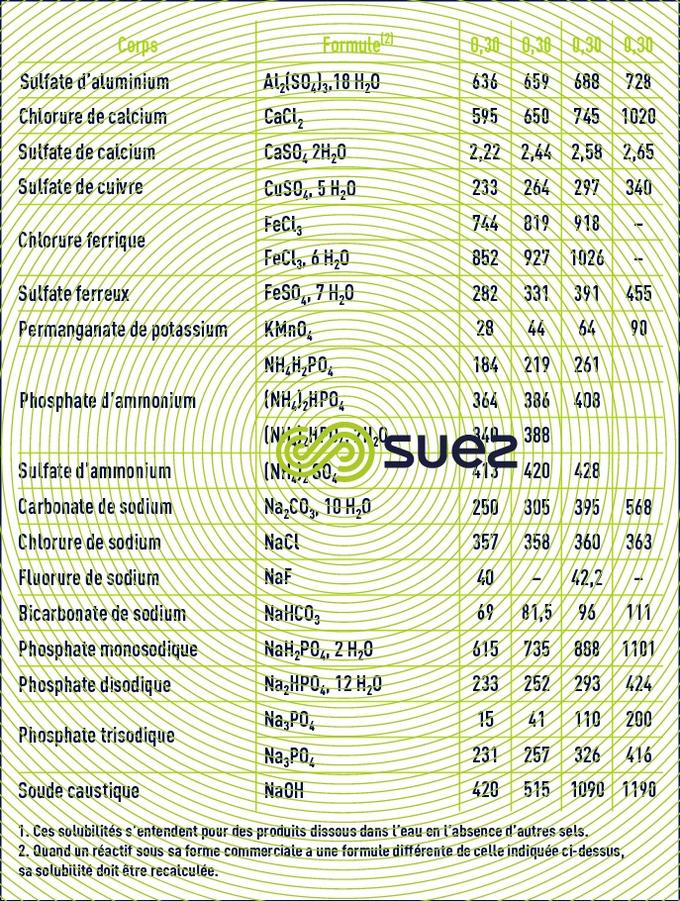

solubilité du sulfate de calcium (figures 13 et 14)

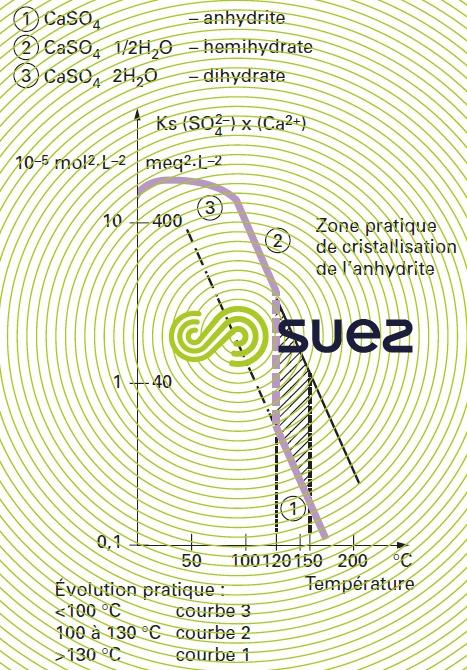


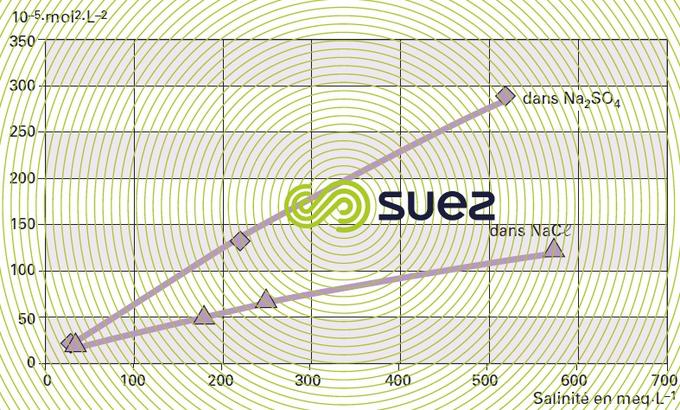

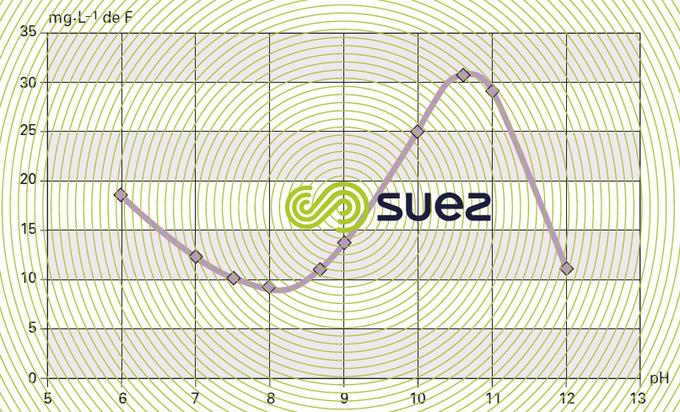
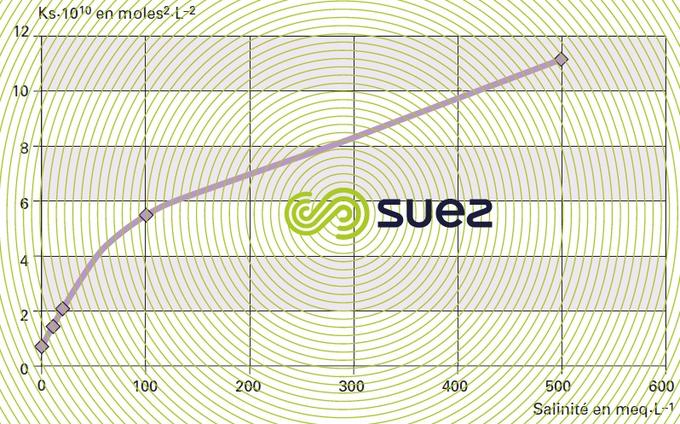
solubilité du fluorure de calcium (figures 15 et 16)




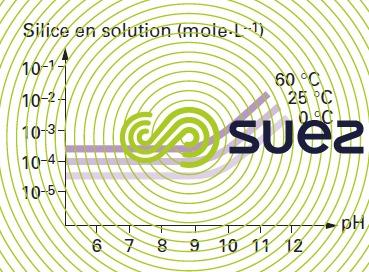
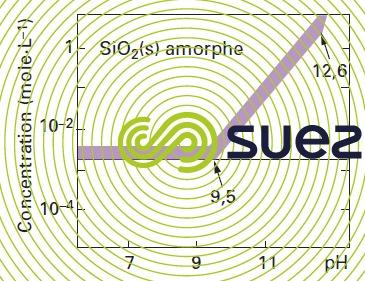
solubilité de la silice
Remarque: en l’absence d’inhibiteurs de polymérisation & la présence de sel influence aussi la solubilité de la silice, en particulier Ca2+ et Mg2+ la diminuent nettement.
Remarque : le quartz (forme cristalline naturelle de la silice) et la silice amorphe ont une solubilité dans l’eau variable selon le pH et la température. La silice est solubilisée sous forme d’acide silicique H4SiO4. La solubilité du quartz en solution aqueuse est inférieure à celle de la silice amorphe.




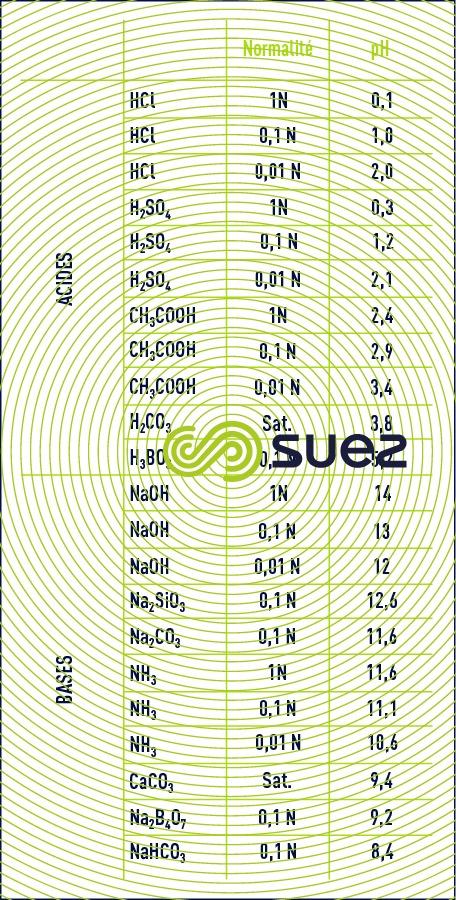
valeurs approximatives du pH de solutions pures


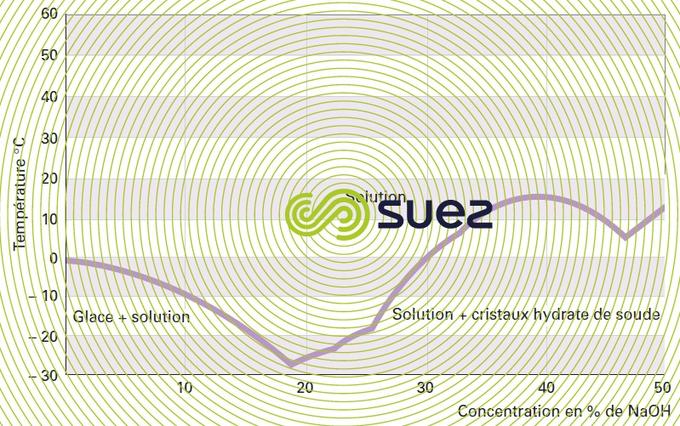
solution de soude (tableau 31, figures 19 et 20)




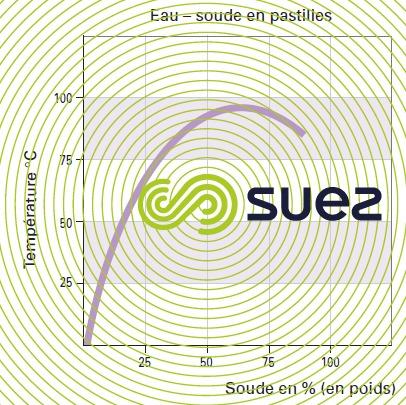

Les réactions de dissolution sont très exothermiques.


solutions d’acide sulfurique (tableau 32, figure 21)

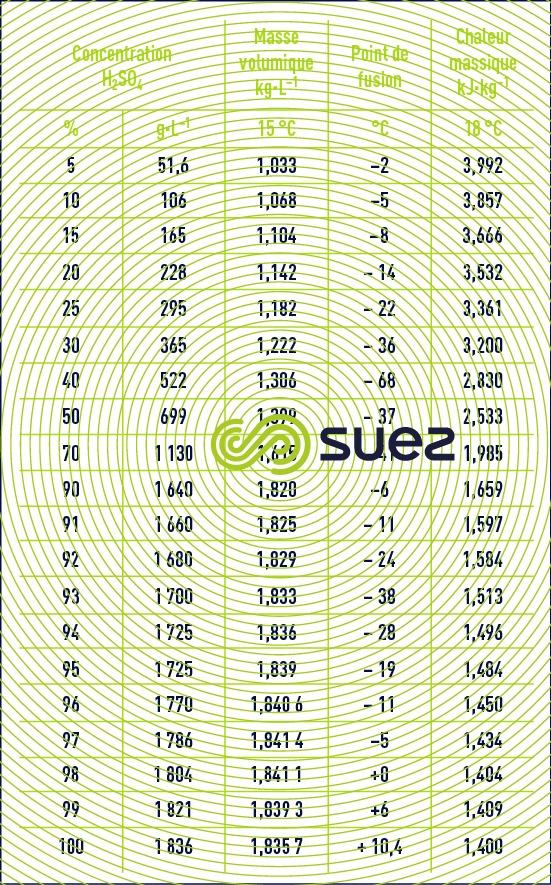


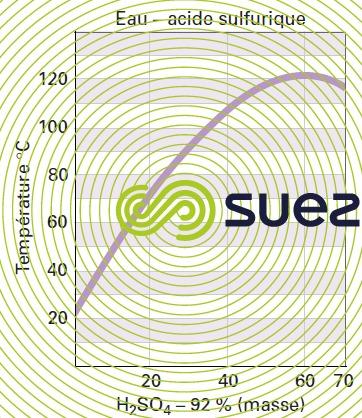

Les réactions de dissolution sont très exothermiques, faire attention au sens du mélange : toujours verser l’acide dans l’eau et non le contraire.
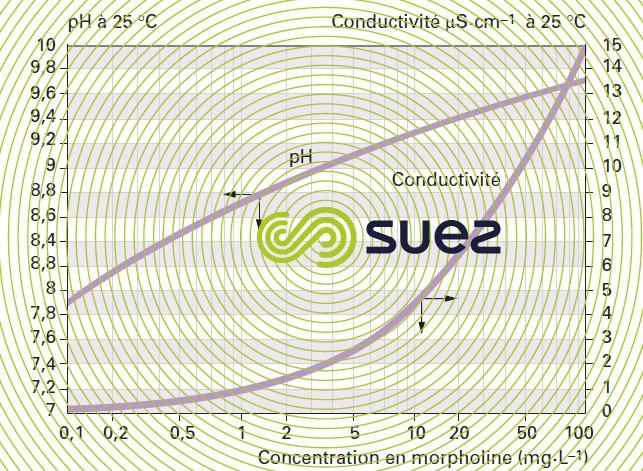
solutions d’ammoniaque et de morpholine (figures 22 et 23)




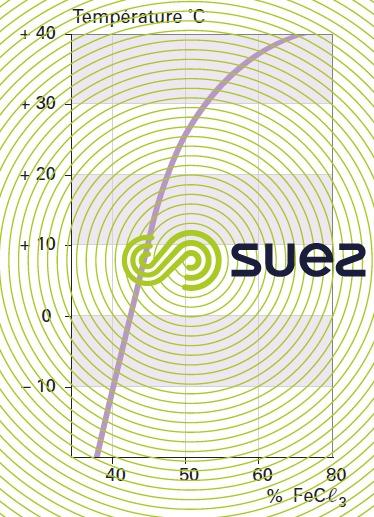
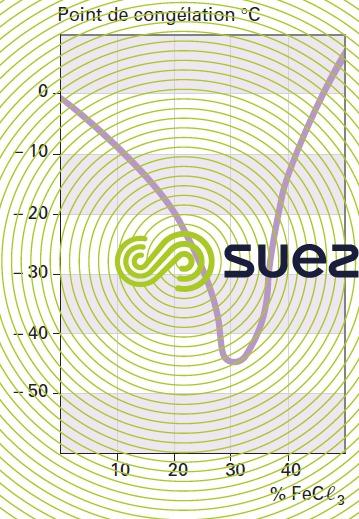
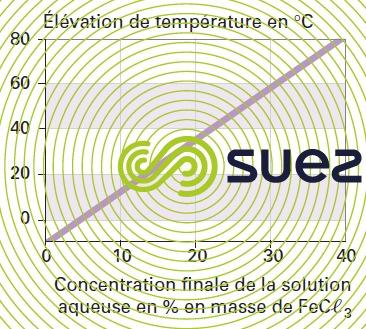
solution de chlorure ferrique (figures 24, 25, et 26)






chaux vive
La figure 27 donne :
- l’élévation de température ;
- les concentrations respectives en g · L–1 CaO ou Ca(OH)2 ;
- les densités,
en fonction de la dilution gramme d’eau par gramme de CaO lors de l’extinction de la chaux vive.

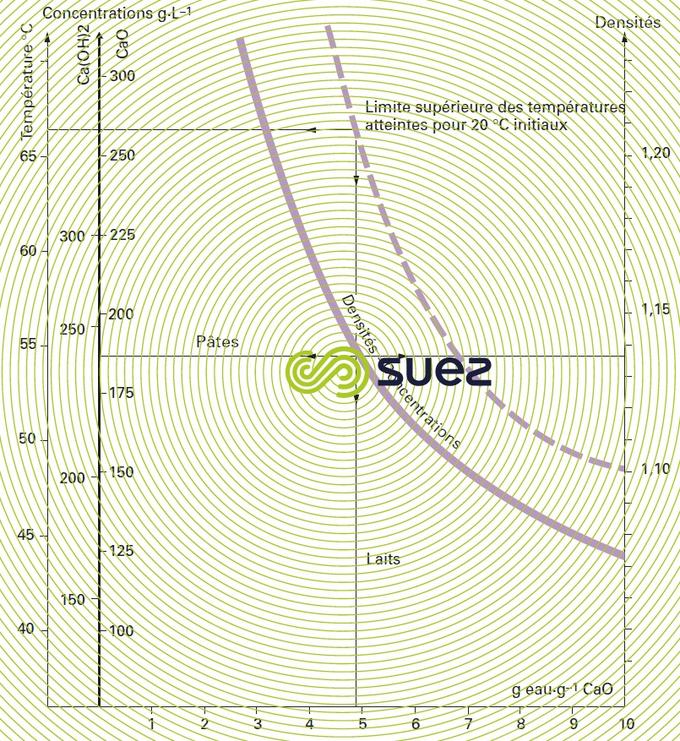

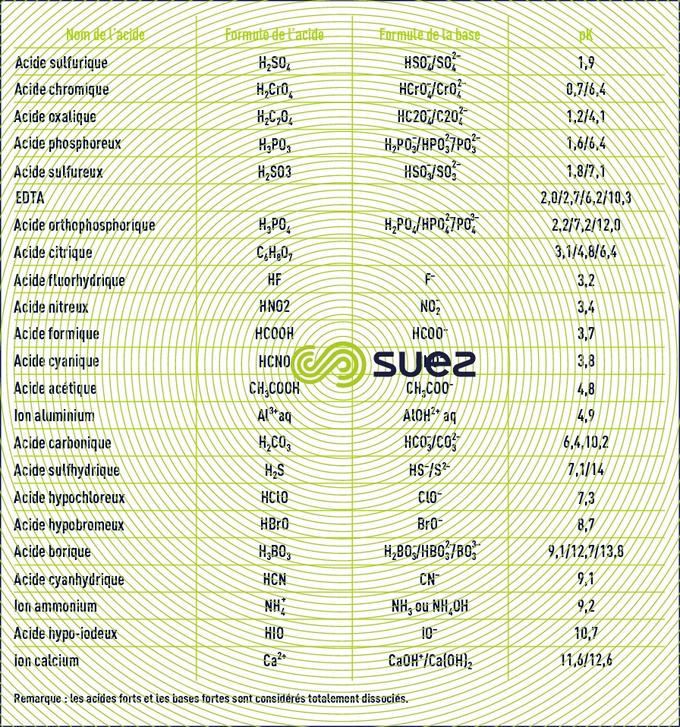
tableau des pK


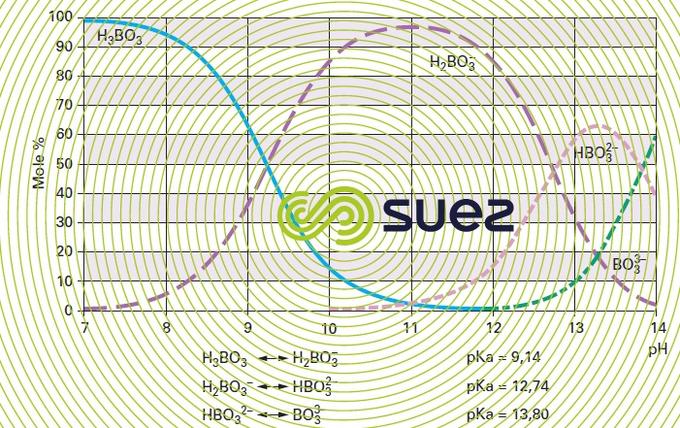
Exemple : dissociation du bore (figure 28) :


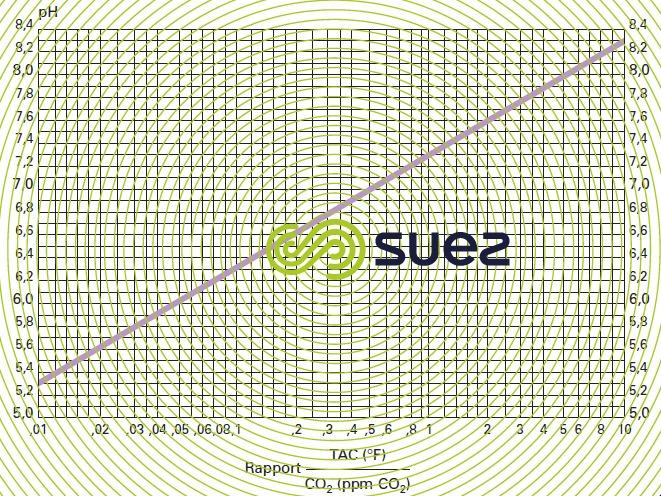
relation pH, TAC, CO2 libre (figure 29)


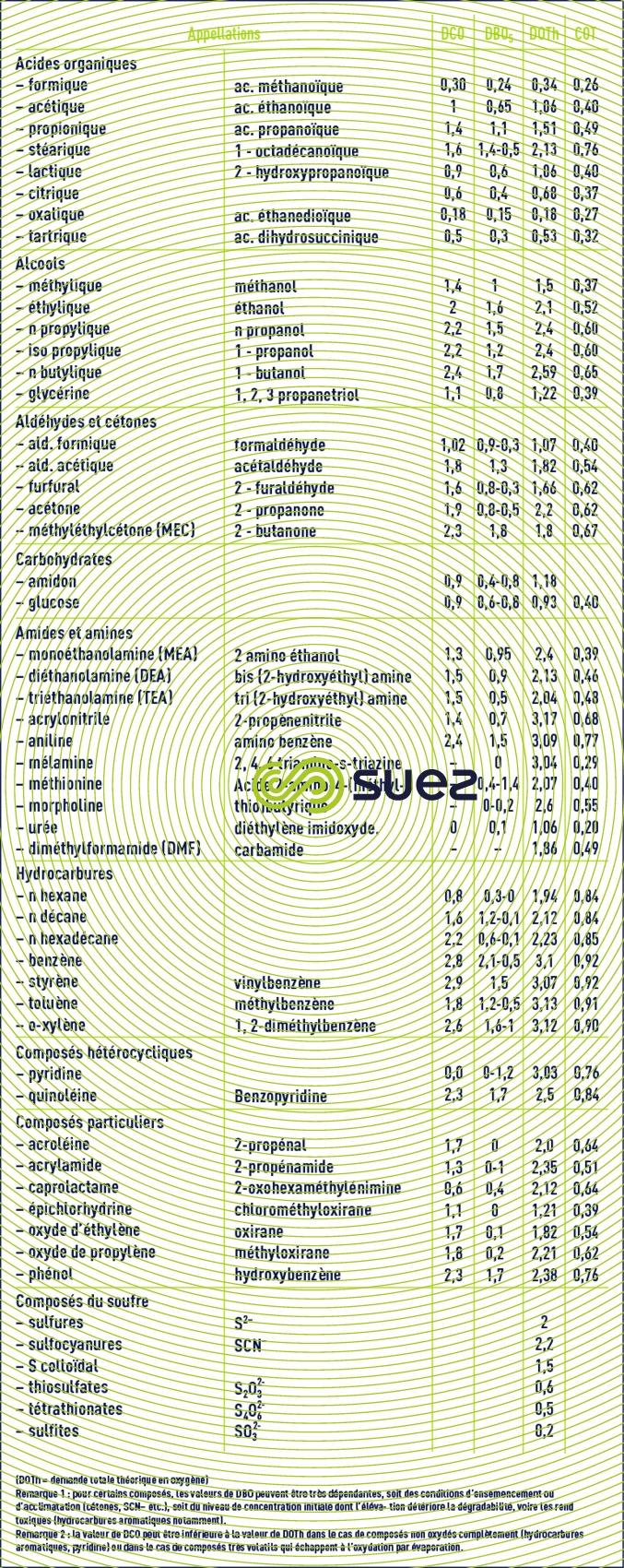
équivalences DCO – DBO5 – DOTh de quelques composés organiques en g par g de composé (tableau 34)


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












