mécanisme adsorption
Temps de lecture :L’adsorption définit la propriété de certains matériaux de fixer à leur surface des ions ou des molécules (gaz, métaux, molécules organiques…) d’une manière plus ou moins réversible. Il y a transfert de matière de la phase aqueuse ou gazeuse vers la surface solide.
La capacité d’adsorption du solide dépend :
- de la surface développée ou surface spécifique (m2·g–1) du matériau. Certains solides dans les milieux naturels (argiles, silice…) possèdent des surfaces spécifiques élevées variables avec l’état physicochimique du milieu aqueux (pH, nature des cations liés). Ainsi certaines argiles comme les bentonites (Montmorillonite par exemple) ont une surface, accessible à la plupart des molécules, variant de 40 à 100 m2·g–1. Leur capacité d’adsorption est très variable mais constitue un paramètre essentiel de la régulation des échanges et de la mobilité des éléments dans le milieu naturel.
Les adsorbants industriels (essentiellement les charbons actifs) développent des surfaces spécifiques bien supérieures (600 à environ 2 500 m2·g–1), caractéristiques d’une très forte microporosité. D’autres adsorbants comme les hydroxydes métalliques formés au cours de la coagulation-floculation développent eux aussi de très grandes surfaces dont l’extension est étroitement dépendante du pH ;
- de la nature de la liaison adsorbat-adsorbant, c’est-à-dire de l’énergie libre d’interaction G entre les sites d’adsorption et la partie de la molécule en contact avec la surface. Cette énergie est directement mesurable dans le cas de l’adsorption des gaz. En revanche, en milieu aqueux, les techniques calorimétriques n’enregistrent que l’enthalpie différentielle d’adsorption correspondant à la différence des énergies d’adsorption des molécules adsorbées et de désorption de l’eau liée à l’interface. Pour l’essentiel, les forces attractives de Van der Waals et les forces électrostatiques (Coulomb) sont à l’origine de l’adsorption. Par exemple, on observe une forte affinité des molécules aromatiques pour la structure graphitique du charbon et une répulsion des molécules polaires non aromatiques ;
- du temps de contact entre le solide adsorbant et les solutés : c’est le temps fourni pour permettre aux polluants de migrer jusqu’à la surface du charbon.
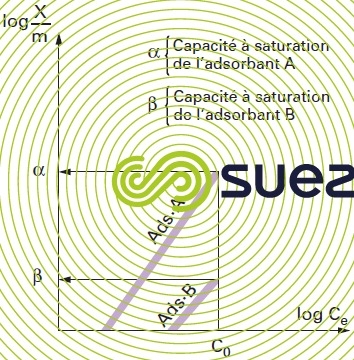
La masse adsorbée de polluant par unité de masse d’adsorbant dépend de la concentration du polluant en phase aqueuse. À l’équilibre il y a échange dynamique entre les molécules de la phase adsorbée et celles restant en solution. De nombreuses théories ont tenté de modéliser la relation existant entre la quantité de molécules adsorbées (g · g–1 ou g · m–2) et la quantité restant en phase aqueuse à l’équilibre. Une des plus employées dans le domaine de l’adsorption sur les charbons actifs est la loi de Freundlich qui établit que :

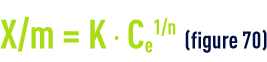
où :
- X/m est la masse fixée de soluté par unité de masse d’adsorbant ;
- Ce la concentration à l’équilibre dans la phase aqueuse des molécules de polluants;
- K et n sont des constantes énergétiques fonction du couple adsorbat/adsorbant pour une température donnée maintenue constante pendant l’expérience (d’où le nom d’isothermes donné aux courbes correspondantes). En fait, aucune modélisation, si « complexe » soit-elle, ne permet de couvrir l’ensemble de l’isotherme et encore moins d’expliquer les mécanismes de l’adsorption. Cela pour la raison essentielle que toute surface est physiquement et énergétiquement hétérogène.


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












