autres précipitations (cas des anions)
Temps de lecture :sulfates
La précipitation des sulfates peut être imposée avant rejet en égout (altération du béton) ou si l’eau doit être réutilisée (entartrage), voire pour satisfaire certaines législations.
Le procédé le plus fréquent et qui concerne de fortes teneurs en SO42– consiste en la précipitation du gypse CaSO4, 2H2O, à froid, par l’addition de Ca2+ sous forme de chaux (cas fréquent des eaux acides) ou de CaCℓ2 (cas des saumures) selon la réaction :

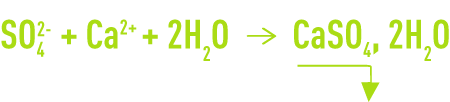
Dans les deux cas, la précipitation sous forme de cristaux hétérogènes est très lente. Pour éviter les sursaturations et les post précipitations dangereuses, la réaction doit s’effectuer en présence d’une très forte concentration en germes (> 20 g · L–1).
Les concentrations en SO42– obtenues dépendent de la salinité, de l’activité ionique du milieu et de l’excès de Ca2+ ; voir constantes caractéristiques de solution, figures 13 et 14 ; les diagrammes de ces figures donnent les ordres de grandeur des produits de solubilité obtenus selon la nature des sels présents.Par exemple, on obtient les teneurs résiduelles :
- 2 à 3 g · L–1 SO42– en épuration de saumures, avec recours à CaCℓ2,
- 1,5 à 2,5 g · L–1 SO42– en neutralisation d’eau acide par la chaux et sans recourir à CaCℓ2.
Un second procédé est la précipitation de sulfate de baryum à partir de l’addition de BaCℓ2. Les solubilités résiduelles obtenues sont inférieures à 20 mg · L–1 mais le réactif est très coûteux et son emploi rare.
Une permutation sur résine anionique forte SO42–/2Cℓ– peut également être envisagée dans les cas intermédiaires au prix de rejets (éluats) concentrés en Cℓ– et SO42–.
fluorures
Leur élimination par précipitation concerne des effluents acides de lavages de gaz d’incinération, de métallurgie de l’aluminium et aussi ceux de l’industrie de l’acide phosphorique, du verre et de l’électronique. Dans ces trois derniers cas, la présence de F– est toujours liée à une concentration importante de silice qui modifie les conditions de précipitation. L’agent de neutralisation sera toujours la chaux, éventuellement complétée par du CaCℓ2, si l’on doit obtenir de faibles valeurs résiduelles de F– :

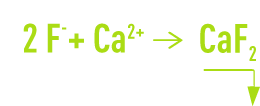
Avec une pollution principalement fluorée et sulfurique ou chlorhydrique, le précipitat est à base de CaF2 dont la cristallisation et la précipitation présentent des cinétiques intermédiaires entre celles de CaCO3 et du gypse. Le dimensionnement des appareils est assez proche de celui des appareils de décarbonatation mais le temps de réaction est plus long.



En précipitation par seul apport de chaux, la solubilité de CaF2 dépend du pH pour une salinité donnée (figure 8). Elle dépend d’autres facteurs et donc aussi du procédé dont sont issus les effluents. Ainsi on obtient :
- de 16 à 30 mg · L–1 en effluents de galvanoplastie ;
- de 2 à 5 mg · L–1 en effluents de fabrication d’acide phosphorique, mais grâce à l’adsorption de F– sur l’hydroxyapatite précipitée ;
- de 20 à 40 mg · L–1 en effluents salins. L’aluminium dissous en concentration notable est un élément complexant défavorable. Réciproquement, lors de la coprécipitation massive d’Aℓ(OH)3 ou Mg(OH)2, ces hydroxydes adsorbent des fluorures et peuvent en diminuer la solubilité résiduelle.
Cette adsorption permet, pour un rapport Aℓ/F = 1, d’obtenir des valeurs de F–résiduel assez basses (2 à 4 mg · L–1).
Avec présence importante de silice, une réaction parallèle s’ajoute :

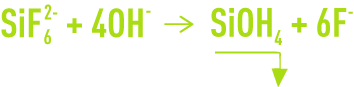
Les concentrations en F– obtenues dépendent de l’enrichissement en Ca2+ du milieu.
La précipitation du gel de silice, abondant et fortement hydraté, est lente et c’est l’épaississement de la boue qui détermine le dimensionnement du décanteur.
phosphates
Ces sels peuvent être présents dans les eaux sous des formes et des concentrations variables :
- acide phosphorique des effluents d’usine d’engrais phosphatés avec présence de HF et de SiO2 ;
- phosphates des eaux usées domestiques ;
- phosphates des purges de chaudières ;
- polyphosphates et hexamétaphosphate de circuits de refroidissement (voir inhibitions de la précipitation).
Deux modes de précipitation sont envisageables :
- effluents acides : par la chaux ;
- eaux non acides : par des sels d’Aℓ ou Fe (formation de phosphates métalliques).
précipitation par la chaux
En fonction de l’acidité initiale on peut avoir deux réactions :
- précipitation de dihydrogéno-phosphate de calcium à un pH optimal de 6 à 7 :


Ce composé décante assez rapidement mais présente une solubilité résiduelle élevée (130 à 300 mg·L–1 en P2O5 selon la température) ;
- précipitation de phosphate tricalcique à un pH de 9 à 12 :

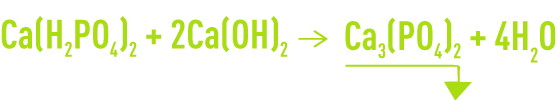
Le phosphate tricalcique présente une solubilité résiduelle de quelques mg · L–1 en P2O5 mais sous forme colloïdale. Il décante lentement même avec l’addition d’un floculant.
Le magnésium éventuellement présent a une action plus complexe
- au-dessous de pH 9, la solubilité du phosphate de calcium augmente avec sa concentration;
- au-dessus de pH 10, le phosphate de calcium coprécipite avec la magnésie avec des valeurs résiduelles inférieures à 1 mg · L–1.
précipitation par Aℓ3+ ou Fe3+
AℓPO4 et FePO4 sont des sels très peu solubles mais qui précipitent à l’état colloïdal. Le précipité est éliminé par floculation sur un excès d’hydroxyde métallique (figure 9).

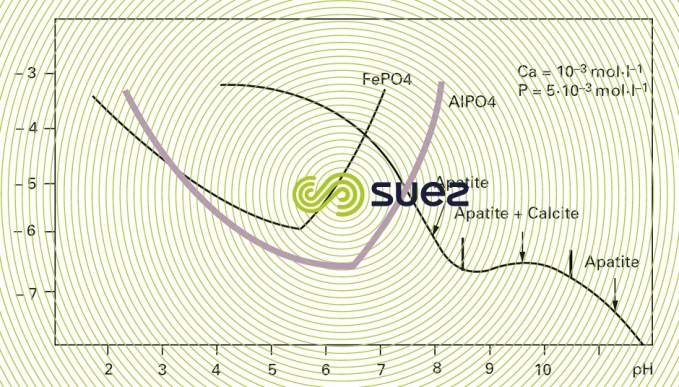

Les valeurs résiduelles en P obtenues peuvent être largement inférieures au mg · L–1 en impliquant des doses de sels de fer ou d’aluminium relativement élevées.



Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












