généralités
Temps de lecture :principe
Les échangeurs d’ions sont des substances granulaires insolubles, comportant dans leur structure moléculaire des radicaux acides ou basiques susceptibles de permuter, sans modification apparente de leur aspect physique, et sans altération ou solubilisation, les ions positifs ou négatifs, « fixés » sur ces radicaux, contre des ions de même signe se trouvant en solution dans le liquide à leur contact. Cette permutation appelée échange d’ions permet de modifier la composition ionique du liquide objet du traitement, sans modification du nombre total de charges existant dans ce liquide avant l’échange.
Les échangeurs d’ions ont d’abord été des terres naturelles (zéolites), puis des composés synthétiques minéraux (silicoaluminates) puis organiques, ces derniers étant presque exclusivement employés actuellement sous le nom de résines. Elles se présentent soit sous forme de grains, soit, pour la majorité d’entre eux, sous forme de billes.
On distingue le squelette de la résine et les sites actifs greffés sur ce squelette. Actuellement, trois types de squelette existent industriellement : polystyrénique, acrylique et formophénolique. Les deux premiers résultent d’une polymérisation (avec formation de billes), le dernier d’une condensation (avec formation de grains). Les squelettes polymérisés sont réticulés par un agent tel que le divinylbenzène. Un fort taux de réticulation accroît la résistance à la fois aux contraintes mécaniques (pertes de charge) et aux contraintes osmotiques (liées au changement de forme ionique).
Les résines de type gel ont une structure homogène.
Les résines à squelette de type macroporeux comportent une porosité obtenue par l’addition d’un solvant porogène. Les macropores obtenus créent une discontinuité dans la structure cristalline qui devient opaque à la lumière. Les résines macroporeuses sont fortement réticulées et présentent une meilleure capacité d’adsorption et de désorption des matières organiques.
Les sites actifs cationiques ou anioniques sont ensuite greffés sur le squelette pour donner des acides ou des bases, leur force dépend du radical fixé (HCO2–, HSO3–, NH3+…).
Par convention une résine ayant des sites actifs greffés anioniques est appelée résine cationique puisqu’elle permettra d’échanger les cations… et vice versa et l’on note cette résine R–Ca ou R–Na selon qu’elle est chargée d’ions Ca2+ ou Na+.
mécanisme de l’échange d’ions
mise en œuvre d’une réaction réversible du type adoucissement


Comme tout équilibre chimique, il est réglé par la loi d’action de masse, la réaction inverse correspondant à la régénération de l’échangeur.
Si le liquide à traiter est mis en contact statique avec l’échangeur, la réaction s’arrête lorsque l’équilibre est atteint entre le liquide et la résine, mais il subsiste pratiquement toujours une fuite ionique plus ou moins importante de l’ion que l’on souhaite fixer.
Lois régissant un échange d’ions réversible : pour chaque réaction mettant en présence deux ions A et B du même signe, il peut être donné une représentation graphique de l’équilibre entre les concentrations respectives de A et de B dans le liquide et dans l’échangeur d’ions (figure 75).

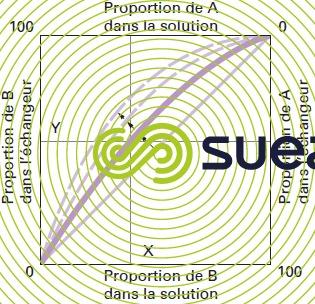

À l’équilibre, on voit que pour une concentration de B égale à X % dans la solution, l’échangeur se sature jusqu’à une concentration de Y %. Lorsque les deux ions A et B ont la même affinité pour l’échangeur, la courbe d’équilibre correspond à la diagonale du carré. Plus la préférence de l’échangeur pour l’ion B est marquée, plus la courbe se déplace dans le sens des flèches.
L’allure de la courbe, pour un système donné de deux ions, dépend d’un grand nombre de facteurs : nature et valence des ions, affinités pour l’échangeur.


Ainsi qu’il est dit plus haut, la seule mise en contact en cuvée de l’échangeur – et du liquide aboutirait à un point de la courbe et s’y stabiliserait.
Si l’on désire traiter jusqu’à élimination poussée d’un ion au profit d’un autre, il faut donc déplacer progressivement l’équilibre en faisant traverser par le liquide une série de couches successives d’échangeur contenant de moins en moins d’ions à fixer, de façon à parcourir la courbe d’équilibre jusqu’au voisinage du zéro de concentration de l’ion indésirable.
Si l’on part d’une couche d’échangeur totalement sous la forme A et si on la fait traverser par un liquide chargé d’ions B, les équilibres successifs entre A et B aboutissent à une série de courbes isochrones de concentration qu’on peut représenter par la figure 76-a) pour deux ions d’affinité similaire, et par la figure 76-b) pour le cas où l’échangeur présente pour l’ion B’ une affinité beaucoup plus grande que pour l’ion A’. Le « point de fuite » est atteint lorsque la courbe isochrone abandonne l’axe vertical de droite (concentration de B positive dans la courbe de sortie du liquide). À ce moment, ces courbes sont représentées par la figure 76-c).

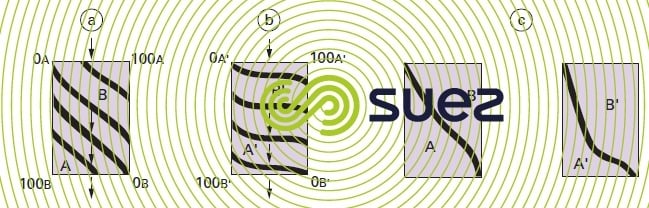



Ceci se matérialise également dans le liquide traité par l’allure des « courbes de saturation » (figure 77).



L’allure de ces courbes dépend non seulement de la courbe d’équilibre statique évoquée plus haut, mais également de la « cinétique d’échange » entre le liquide et l’échangeur, cinétique qui fait intervenir la pénétration des solutés dans l’échangeur, régie par des lois dites « équilibres de Donnan ».
Ces phénomènes sont très complexes ; ils intéressent à la fois le degré de dissociation et la concentration des ions, la température, la nature de l’interface échangeur-liquide et la cinétique de pénétration à l’intérieur du solide qui constitue cet échangeur.
La capacité totale d’un échangeur d’ions, c’est-à-dire le nombre total d’équivalents disponibles pour l’échange par litre d’échangeur, n’a qu’une valeur pratique toute relative, le facteur industriel à prendre en considération étant la « capacité utile » définie à partir des graphiques isochrones ou des courbes de saturation décrits plus haut.
Dans la pratique, la qualité du liquide traité ne dépend que de l’état de saturation de la dernière couche traversée par ce liquide, quel que soit l’état des couches précédentes.

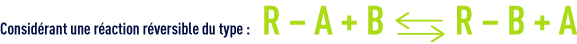
qui représente la « fixation » de gauche à droite et la « régénération » de droite à gauche, il y a lieu d’examiner l’état de l’échangeur au début d’un cycle de fixation succédant à un cycle de régénération. On voit aisément qu’au début du cycle de fixation, la qualité de l’eau traitée, caractérisée par la fuite ionique, dépend essentiellement du degré de régénération de la couche de sortie de l’échangeur.
mise en œuvre d’une réaction non réversible
C’est le cas de la fixation d’un acide fort par un échangeur d’anions fortement basique (réaction de neutralisation) :


La réaction inverse (hydrolyse) n’existe pratiquement pas, l’échange est total et peut être obtenu aussi bien en contact statique qu’en percolation. Dans ce cas, la fuite ionique peut être nulle, à condition que le temps de contact entre l’eau et la résine soit suffisant… la régénération de la résine sous forme chlorure n’est possible qu’en utilisant une base forte :


On peut assimiler à cette catégorie d’échange les réactions d’équilibre qui donnent naissance à un composé insoluble. Par exemple, si l’on traite de l’eau de mer avec un échangeur saturé d’ions argent, on obtient :


AgCℓ insoluble, précipite. Dans ces conditions, d’après les lois de Berthollet, l’équilibre se déplace totalement, et la réaction est complète, même en contact statique.
Les deux types de réactions ci-dessus peuvent être utilisés :
- pour éliminer du liquide traité un ou plusieurs ions indésirables ;
- pour sélectionner et concentrer dans l’échangeur un ou plusieurs ions qui se retrouveront ensuite à l’état purifié et concentré dans le liquide de régénération.
utilisation d’anion complexe préalablement fixé
Cet ion complexe est susceptible de provoquer des réactions secondaires, par exemple des phénomènes d’oxydoréduction sur les ions de l’eau ou du liquide traité, sans entrer lui-même en solution dans le liquide.
Exemple : fixation de l’oxygène dissous par oxydation d’une résine anionique sulfitée (R-NH3-S03H) en résine sulfatée (R-NH3-SO4H).
autres utilisations
Indépendamment de l’échange d’ions, les résines peuvent être utilisées en tant que catalyseur (par exemple acide) ou en tant qu’adsorbant, décolorant…
méthodes de régénération
Dans le cas des procédés d’adoucissement et de déminéralisation, la fin du cycle se produit lorsque la courbe de saturation correspond à celle de la figure 76-c) (composés A' et B'). On peut alors considérer, au moins en ce qui concerne les couches supérieures, que l’échangeur d’ions est pratiquement saturé en ions B' et est en équilibre avec la concentration de B' dans la solution influente.
La régénération est effectuée par percolation d’une solution concentrée d’ions A', soit dans le même sens que la saturation (régénération à cocourant), soit en sens contraire (régénération à contre-courant).
régénération à cocourant
Au cours de cette opération (figure 78), la solution concentrée d’ions A' est d’abord mise au contact de couches d’changeurs d’ions saturé en ions B', qui vont être chassés de la résine ; ces ions B' sont ensuite transportés vers des couches d’échangeurs d’ions qui sont dans un état de moindre saturation et ils retrouvent alors des conditions favorables à leur fixation ; ce sont donc principalement des ions A' restant dans les couches basses de la colonne qui sont élués au début de la régénération.

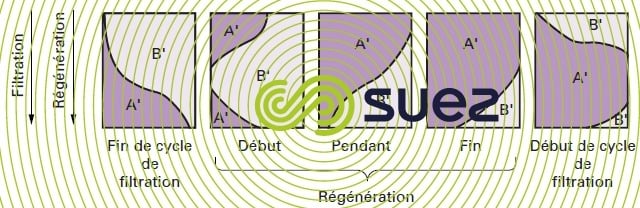

Enfin, si la quantité de régénérant est limitée, les ions B' ne sont pas totalement élués de l’échangeur d’ions et les couches inférieures ne sont pas parfaitement régénérées.
En conséquence, au cycle suivant, les ions B' subiront une autorégénération par les ions A' déplacés des couches supérieures.
Il apparaît donc que, pour une bonne régénération de l’échangeur d’ions, il est pratiquement nécessaire de faire intervenir une quantité de régénérant A' double du rapport stœchiométrique A'/B'.
régénération à contre-courant
Les phénomènes sont différents lorsqu’on injecte les réactifs de régénération de bas en haut ; en effet, dans ce cas, les ions A' concentrés rencontrent d’abord des couches de résine peu concentrées en ions B' dont l’élution se fait donc dans de bonnes conditions ; de plus, dans les couches, supérieures saturées, les ions B' ne peuvent pas se refixer (figure 79).

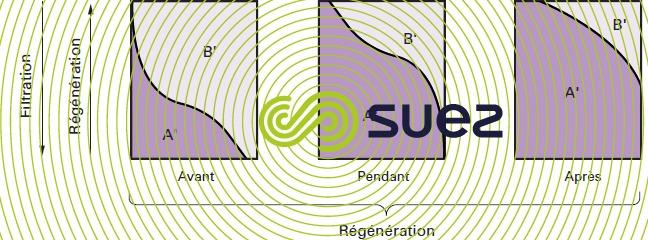

Deux avantages importants du principe de la régénération à contre-courant doivent être soulignés :
- amélioration du rendement et par conséquent diminution des consommations de réactifs à capacité utile égale ;
- amélioration de la qualité de l’eau traitée, les couches de sortie étant régénérées avec un fort excès de réactif.
vocabulaire de l’échange d’ions
Capacité (ou pouvoir d’échange) d’un échangeur : c’est la quantité d’ions susceptibles d’être fixés par unité de volume ou par unité de poids. La capacité est exprimée en équivalent ou en degrés français par unité de poids ou de volume de résine tassée.
On distingue :
- la capacité totale, qui est la quantité maximale d’ions échangeables et qui caractérise une résine donnée ;
- la capacité utile, qui est la fraction utilisable de la capacité totale et qui dépend des conditions hydrauliques et chimiques de chaque cas d’application.


Ce rapport est toujours supérieur ou égal à 100 % (100 % correspondant à la stœchiométrie).
- Fuite ionique (leakage) : concentration de l’ion à fixer demeurant dans l’eau traitée. Elle est exprimée en mg · L–1, mg · L–1, milliéquivalents/litre, parfois en % par rapport à l’influent.
- Claquage : fuite ionique maximale admissible nécessitant l’arrêt du cycle de production.
- Attritition : usure mécanique des billes d’échangeurs au cours de leur utilisation.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












