les membranes de dessalement
Temps de lecture :Appelées ainsi car elles rejettent des ions (sels) et des solutés organiques, ces membranes ne comportent pas de pores. L’eau s’y déplace en diffusant dans la structure même du polymère qui dans tous les cas est hydrophile et « gonflé » par l’eau.
Ces membranes sont elles-mêmes classifiées, comme on le verra en membranes d’osmose inverse et de nanofiltration.
transport à travers la membrane
Une membrane d’OI idéale ne permet que le passage de l’eau rejetant tous les solutés, à l’exception de quelques molécules organiques très voisines de l’eau (faible masse molaire et polarité forte, ex. éthanol, méthanol, formol).
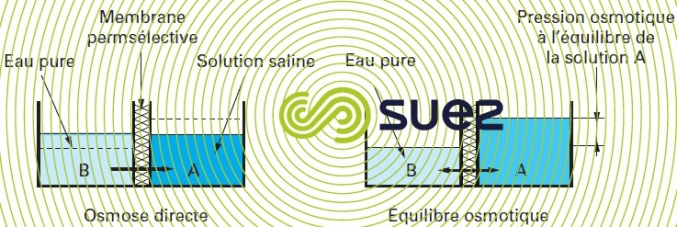
Mécanisme : si l’on sépare une solution saline concentrée d’une solution plus diluée par une telle membrane dite aussi permsélective (figure 51), la différence de potentiel chimique tend à faire passer l’eau du compartiment à bas potentiel vers celui à potentiel plus élevé pour diluer celui-ci (osmose directe). À l’équilibre, la différence de pression ainsi créée est appelée pression osmotique du système (figure 51). Si l’on veut empêcher cette diffusion, il faut exercer une pression sur le fluide « salé », égale à la pression osmotique et si l’on veut « inverser » le sens d’écoulement de l’eau, la pression doit être supérieure à pression osmotique.


Une équation simple relie pression osmotique et concentration dans le cas de solutions diluées, connue sous le nom de loi de Van’t Hoff :



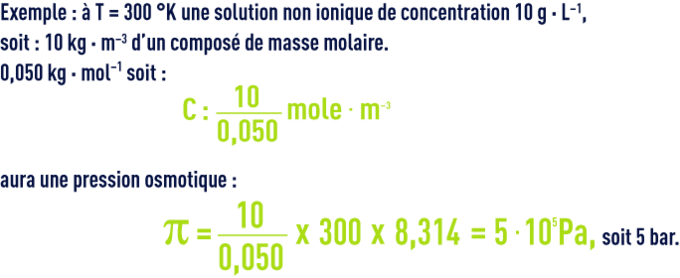
À la même concentration :
- pour un composé de masse molaire 0,5 kg · mol–1, π = 0,5 bar ;
- pour une macromolécule de masse molaire 50 kg · mol–1, π = 0,05 bar…
On constate que plus la molécule est petite (faible masse molaire) plus la pression osmotique créée par une même concentration est élevée. Le tableau 16 donne les concentrations de divers composés qui exercent une même pression osmotique de 10 bar.



On notera que pour les sels ionisés la même formule s’applique en prenant la concentration molaire de chacun des ions ce qui, pour un sel composé d’ions monovalents parfaitement dissociés, multiplie par deux la pression osmotique exercée par rapport au composé non dissocié de même masse molaire.
Si plusieurs ions et composés non ioniques contribuent à la pression osmotique :

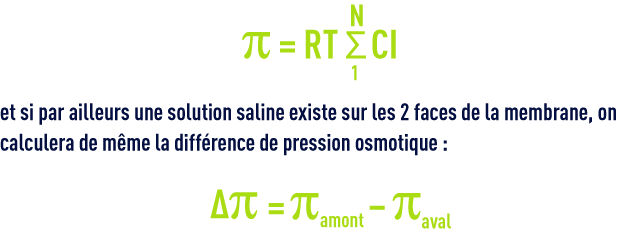
Pour l’eau de mer à 35 mg · L–1 π = 28,5 bar soit environ 0,8 bar/g de sels dissous.
La figure 52 montre que la loi de Van’t Hoff n’est respectée que par les « faibles concentrations » par exemple pour le NaCℓ jusque vers 30 g · L–1.

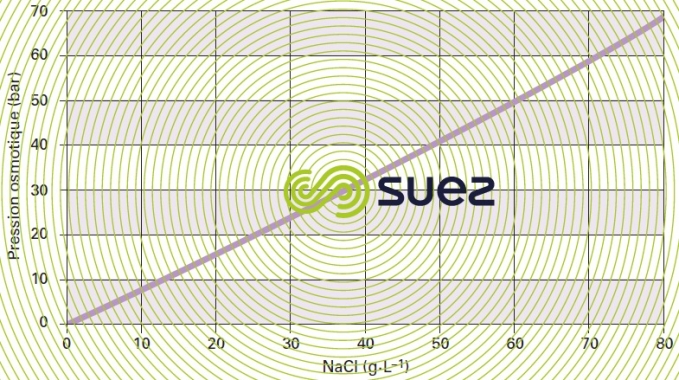

En fait, pour produire de l’eau « pure » à partir d’une solution saline, il faut donc dépasser la pression osmotique de la solution soit pour une eau saumâtre contenant quelques grammes de sel par litre, des pressions allant de 5 à 15 bar et pour l’eau de mer (35 à 45 g · L–1) des pressions allant de 50 à 80 bar.
Un deuxième phénomène vient amplifier cet effet. Comme l’illustre la figure 53, lors du transfert de l’eau, les molécules et ions retenus par la membrane ont tendance à s’accumuler le long de celle-ci dans la couche limite et donc à augmenter la salinité réellement « traitée » par la membrane et donc la pression osmotique qui doit être « vaincue » pour dessaler la solution. Ceci se traduit par un coût énergétique plus élevé, mais aussi le risque d’entraîner des précipitations si le produit de solubilité d’un des couples cation-anion présents est dépassé dans la couche limite le long de la membrane.

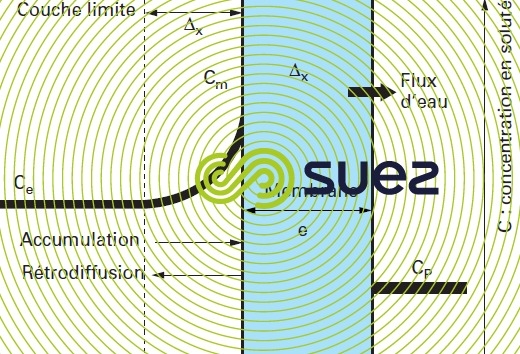

Ce phénomène est appelé polarisation de concentration de la membrane et caractérisé par le coefficient

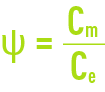
avec :
Cm : concentration du liquide au contact de la membrane,
Ce : concentration du liquide à traiter.
Ce phénomène peut être minimisé par le balayage accru de la face amont de la membrane qui limite l’épaisseur de la couche limite et facilite la rétrodiffusion des solutés rejetés mais ceci revient à limiter la fraction d’eau dessalée. Dans les systèmes de dessalement industriels, on cherche à maintenir le coefficient y entre 1,05 et 1,4.
Pour décrire les phénomènes observés, le modèle le plus utilisé fait appel aux lois de la diffusion et les flux d’eau sont en première approximation proportionnels à la différence de pression efficace (ΔP – Δp) et les flux de sel à la différence de concentration (ΔC).
pour l’eau
On peut écrire :


avec :
Qp : débit d’eau à travers les membranes,
Kp : coefficient de perméabilité à l’eau de la membrane,
S : surface de la membrane,
ΔP : différence de pression de part et d’autre de la membrane,
Δp : différence de pression osmotique de part et d’autre de la membrane,
Kt : coefficient de température.
Le débit d’eau à travers la membrane est donc directement proportionnel au gradient de la pression effective.
Le coefficient Kt tient compte de la viscosité de l’eau. Celle-ci diminue quand la température augmente. Le débit est donc plus important quand la température s’élève (2,5 à 3 % d’écart par degré autour de 15 °C).
pour les sels


Kt : coefficient de température.
Le débit de sel est directement proportionnel au gradient de concentration à travers la membrane et, pour une membrane et une solution donnée, sa valeur est indépendante de la pression appliquée.


Cette concentration (qualité de l’eau produite) est donc proportionnelle au gradient de concentration à travers la membrane et inversement proportionnelle au gradient de pression effective (ΔP – Δp).
Sur tout système d’OI on observe donc les tendances suivantes (tableau 17) découlant des équations (1) et (2).



Dans la pratique on observe souvent que la croissance de la pression accroît moins la qualité et le flux que prévu par les équations 1 et 3 précédentes, en effet :
- lorsque le flux croît, Y croît donc Δp et ΔC croissent ; le gain sur le débit et la qualité sont donc réduits ;
- par ailleurs, alors que les solutés rétrodiffusent, les macromolécules et colloïdes eux s’accumulent sur la membrane (voir salissure) aussi, avant de pousser le flux, il faut s’assurer que la qualité physique du liquide à traiter le permette, faute de quoi l’effet peut même s’inverser ; salissure (fouling) et concentration de polarisation deviennent prépondérantes. On retrouvera cette problématique au séparation par membranes.
mise en œuvre et bilan autour d’une membrane
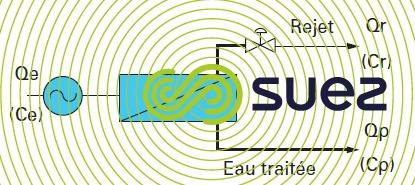
Le système d’osmose le plus simple, figure 54, sera constitué des éléments suivants :
- une pompe haute pression pour fournir l’énergie au système ;
- un module ou ensemble de modules ;
- une vanne sur le rejet permettant de maintenir la pression dans le système.




En fait, l’une, le PS dépend essentiellement du choix de la membrane.
Les autres, Y et donc FC, dépendent du choix d’utiliser plus ou moins d’eau brute pour une production donnée, mais ce choix est fondamental en effet :
- lorsque Y augmente, le coût énergétique par m3 produit E décroît puisque l’on a pressurisé moins d’eau pour une même production ;
- mais en même temps Cr et FC augmentent, et en conséquence la qualité de l’eau produite décroît puisque, d’une part la concentration moyenne devant la membrane croît de Ce à l’entrée à Cr à la sortie, (ce qui nécessite de remplacer dans les équations précédente Ce par concentration moyenne le long de la membrane) et donc la quantité de sel croît, d’autre part le flux d’eau décroît puisque Qp décroît (en effet la pression osmotique p proportionnelle à

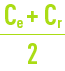 croît).
croît).
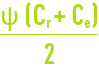
Remarques :
- On verra au séparation par membranesles conséquences positives (moins de rejet à évacuer) mais souvent négatives (entartrage, salissure) qu’entraîne la croissance de Y et donc de FC.
- La décroissance de l’énergie spécifique quand Y croît n’est pas uniforme, un minimum est atteint puis une croissance peut être observée lorsque la pression utile ΔP – Δp devient trop faible.
osmose inverse
Ces membranes rejettent les sels ionisés, plus difficilement les molécules non ioniques et très peu ou pas du tout les gaz dissous : O2, CO2…).
On verra au niveau de la séparation par membranes que l’on désigne sous ce terme les membranes ayant une PS allant de :
- 0,3 à 5 % pour les ions monovalents ;
- 0,05 à 1 % pour les ions bivalents.
On note que ces valeurs sont assez faibles, aussi, souvent et en première approximation, on est amené à négliger CP devant Ce ou Cr, ce qui simplifie les équations ci-dessus mentionnées, et permet d’écrire

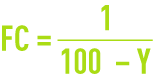
Ces membranes sont utilisées dans tous les systèmes de dessalement :
- d’eau de mer pour obtenir de l’eau potable ou de procédés (chaudières…) ;
- d’eau saumâtre (mêmes applications) ;
- d’eau douce pour obtenir de l’eau déminéralisée, voire eau ultrapure ;
- …
En revanche, la pression osmotique étant très variable, on utilisera des membranes et modules différents, principalement par leur pression d’utilisation (5 à 80 bar) et leur flux (10 à 40 L · m–2·h–1), ce qui conduit à des coûts d’investissement et de fonctionnement très différents (voir séparation par membranes).
On notera également que de telles membranes rejettent parfaitement toutes les macromolécules (PM > 300 D) et a fortiori toutes particules y compris les colloïdes les plus fins.
nanofiltration
Il s'agit d'une variante des membranes d' OI, d'introduction plus récente, caractérisée par :
- un passage des sels monovalents relativement élevé : 10 à 80 %,
- un passage des sels bivalents beaucoup plus faible: 1 à 10 %,
- un passage des solutés organiques qui reste équivalent plus élévé que à celui des membranes d’osmose.
Le principal intérêt de ces membranes est donc, en tolérant un passage élevé des sels monovalents (qui contribuent le plus à la pression osmotique) de limiter ∆π donc l'énergie à mettre en œuvre pour obtenir
- un dessalement partiel associé à un bon adoucissement,
- une purification des eaux vis-à-vis de leurs polluants organiques par exemple une très bonne décoloration des eaux naturelles, l’élimination des précurseurs de THM, voire la plupart des pesticides….
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.














