élimination de la dureté (calcium et magnésium)
méthodes principales
décarbonatation à la chaux
réactions de base
Les réactions chimiques de décarbonatation sont les suivantes :

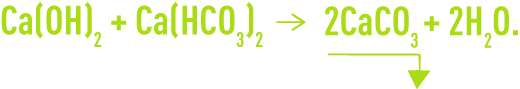
Toutefois si, comme le plus souvent, l’eau contient du CO2 libre, celui-ci réagit le premier sur la chaux pour former de l’hydrogénocarbonate :


d’où une augmentation du TAC et du TCa, dans un premier temps, avant que la réaction (1) ne prenne le relais.
Si TCa < TAC (eau bicarbonatée calcique et magnésienne) on a ensuite :

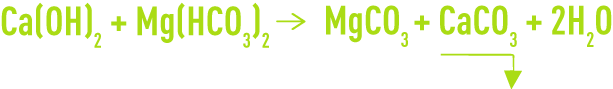
Le carbonate de magnésium étant relativement soluble (de l’ordre de 70 mg · L–1) un excès de chaux conduira à la réaction :

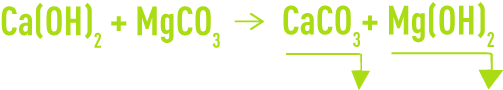
et si les doses de réactif sont exactement ajustées, on réduit l’alcalinité de l’eau à la solubilité théorique du système CaCO3 + Mg(OH)2 qui est comprise entre 2 et 3 °F dans les conditions usuelles de concentration et de température.
Cependant, cette valeur limite du TAC peut se trouver augmentée dans la pratique par la présence d’impuretés dissoutes (ex. : acides organiques, ammonium, phosphates…).
Comme les équations ci-dessus le montrent, ces réactions ne permettent d’éliminer que la dureté bicarbonatée (TH équilibré par du TAC). Elles n’éliminent donc ni la dureté permanente (TH – TAC > 0), pour ce faire, il faut ajouter du carbonate de sodium, ni les bicarbonates non associés à la dureté (eaux bicarbonatées sodiques), pour ce faire, il faut ajouter un excès de chaux.
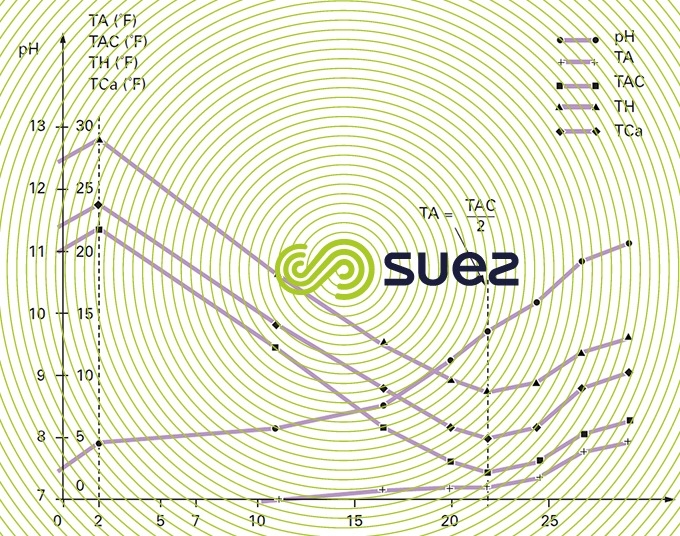
La figure 5 récapitule sur un exemple d’eau bicarbonatée calcique l’évolution des différents titres en fonction de la dose de chaux ajoutée.


mécanisme de la cristallisation
Le carbonate de calcium formé est cristallin et comme tel a une cinétique de précipitation qui suit les lois de la germination-cristallisation, à savoir :
- en l’absence de germes de cristallisation, la précipitation est très lente, l’eau reste en sursaturation et la précipitation tend à s’effectuer sur les quelques matières en suspension présentes mais surtout sur les surfaces disponibles, principalement si elles sont métalliques (paroi des réacteurs, agitateurs, canaux, vannes…). On observera donc un entartrage progressif mais souvent rapide ;
- au contraire, en présence de cristaux, la précipitation est très rapide et en quelques minutes l’équilibre est atteint. Ceci est du moins vrai tant que la surface des cristaux disponibles reste suffisamment « propre » : absence d’impuretés telles que polymères organiques adsorbés, colloïdes, hydroxydes métalliques. En particulier lorsque Mg(OH)2 est précipité, il va tendre à ralentir la précipitation et surtout à alléger beaucoup les agrégats cristallins formés. Il faudra en conséquence grossir le réacteur et le séparateur utilisés, voir floculateurs - décanteurs - flottateurs.
Un bon appareil de décarbonatation doit donc comporter :
- une zone de mélange intime entre cristaux recirculés, eau à traiter et chaux ;
- une zone de décantation d’où les cristaux formés sont séparés et partiellement retournés dans la 1re zone.
L’emploi d’un coagulant et/ou d’un floculant est nécessaire pour améliorer la vitesse de décantation et permettre l’emploi d’un décanteur rapide (type Densadeg avec des vitesses > 30 m · h–1).
emploi du carbonate de sodium
L’élimination de la dureté permanente est obtenue par le carbonate de sodium à froid, associé ou non avec la précipitation des bicarbonates de calcium et de magnésium par la chaux. Cette élimination se fait suivant les réactions :

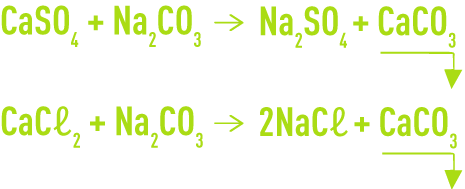
Ce procédé ne permet toutefois pas d’abaisser le TAC au-dessous de 3 ou 4 °F dans les cas les plus favorables.
précipitation par la soude caustique
L’élimination des ions calcium et magnésium par précipitation par la soude est une variante du procédé de traitement conjoint par la chaux et le carbonate de sodium, décrit plus haut.
La réaction de base est la suivante :


La précipitation du carbonate de calcium s’accompagne de la formation de carbonate de sodium qui réagira sur la dureté permanente suivant les réactions (5) et (6) ci-dessus.
L’utilisation de la soude permet donc d’abaisser la dureté d’une eau d’une valeur égale à deux fois la diminution de la teneur en bicarbonates alcalinoterreux. Le TAC de l’eau ne peut être abaissé à environ 3 à 4 °F que s’il existe suffisamment de dureté permanente pour se combiner avec le carbonate de sodium formé. L’emploi de soude n’est donc recommandé que dans ce cas ; mais il peut être également envisagé pour l’adoucissement partiel des eaux dans lesquelles TCa > TAC.
calcul et contrôle de la précipitation (obtention d’un TAC minimal)
On appelle :
- TCa titre hydrotimétrique calcique en °F correspondant à la teneur globale en calcium;
- TMg titre hydrotimétrique magnésien en °F correspondant à la teneur globale en magnésium;
- C teneur en CO2 libre exprimée en °F :


dose de chaux
TH-TAC positif
La dose théorique de chaux nécessaire pour obtenir la précipitation optimale du seul carbonate de calcium est suivant la réaction (1) :

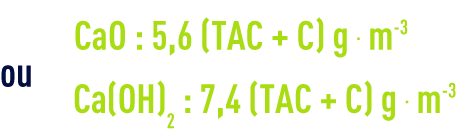
Si on doit précipiter à la fois le carbonate de calcium et de la magnésie (correspondant au Mg lié au TAC), le TMg étant supérieur à TH-TAC (titre Mg(CO3H)2 = TAC-TCa), la dose de chaux nécessaire sera :

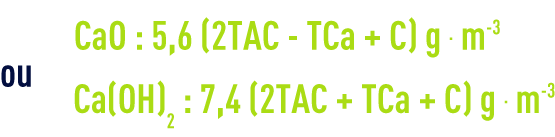
TH-TAC négatif
Ceci concerne les eaux bicarbonatées sodiques. On peut toujours obtenir une bonne précipitation du calcium et du magnésium en calculant la chaux sur TAC + C, mais on produira ainsi une eau chargée en soude caustique, et on peut avoir intérêt à employer une dose plus faible. Ceci revient alors à ne précipiter que le CaCO3 pour éliminer l’ion le plus entartrant soit :

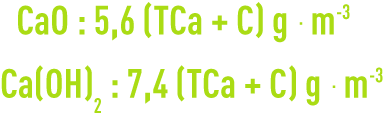
contrôle des résultats
Dans tous les cas, il faut augmenter (ou diminuer) la dose de chaux de 5,6 g par m3 (en CaO) ou 7,4 g par m3 (en Ca(OH)2) par degré de TA mesuré en plus ou en moins autour de la règle théorique.
Bien entendu, les valeurs 5,6 et 7,4 s’entendent pour des produits à 100 %. En fait, les chaux sont toujours impures et plus ou moins carbonatées et les valeurs industrielles sont à majorer suivant les situations de 10 à 30 %. Si on se borne à précipiter le carbonate de calcium, le réglage idéal est obtenu pour :

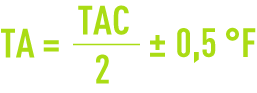
réglage qui correspond à un minimum de TAC de 2 °F environ si l’eau ne contient pas de magnésium, ni de composés inhibiteurs de la cristallisation.
Si TMg est supérieur à TH-TAC, l’application de cette règle conduit à des TAC excessifs du fait de la solubilité du carbonate de magnésium et le résultat optimal est obtenu quand on a :

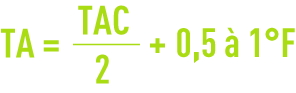
avec une valeur du TA aussi faible que possible.
dose de carbonate de sodium
La dose de carbonate de sodium nécessaire est en produit pur :


contrôle des résultats
En théorie, pour une eau exempte de magnésium on doit obtenir


En pratique, si on a affaire à une eau dont la dureté permanente est en partie magnésienne, cette règle peut ne plus être observée et le problème doit alors être examiné au cas par cas.
dose de soude
La dose de soude caustique à utiliser est, en produit pur, de :

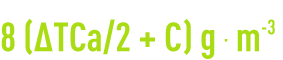
contrôle des résultats
Pour un abaissement de 1 °F du TAC on doit avoir une diminution de 2 °F du TH.
En pratique, on règle la dose de soude caustique introduite dans l’eau de façon à obtenir la valeur minimale de TAC résiduel.
cas particulier de la décarbonatation partielle
Si on ne recherche qu’un abattement partiel (ex. : EP ) de la dureté calcique, désigné par D TCa, on appliquera une dose de chaux basée sur C + D TCa (ou C + D TAC). Si le réactif utilisé est la soude, le calcul est le même que ci-dessus :


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













