l'équilibre calco-carbonique
Temps de lecture :généralités : les eaux naturelles
Comme vu aux sections chimie de l'eau , langage des analystes de l'eau et les eaux naturelles, c’est la structure géologique du sol qui recueille, draine, et stocke une eau qui contribue à déterminer « le faciès » de celle-ci.
Les massifs granitiques peu solubles vont être associés à des eaux peu chargées en sels, mais pouvant contenir beaucoup de CO2 (en fonction de la qualité des couches supérieures) ; à l’inverse, les zones alluvionnaires et karstiques vont produire des eaux à fortes concentrations ioniques, en particulier en ions Ca2+, Mg2+ et HCO3–. Au cours de leur trajet en surface (rivières-lacs), les eaux s’équilibrent avec l’atmosphère, reçoivent des pollutions… ce qui peut modifier peu à peu leurs caractéristiques initiales.
eaux douces/eaux dures
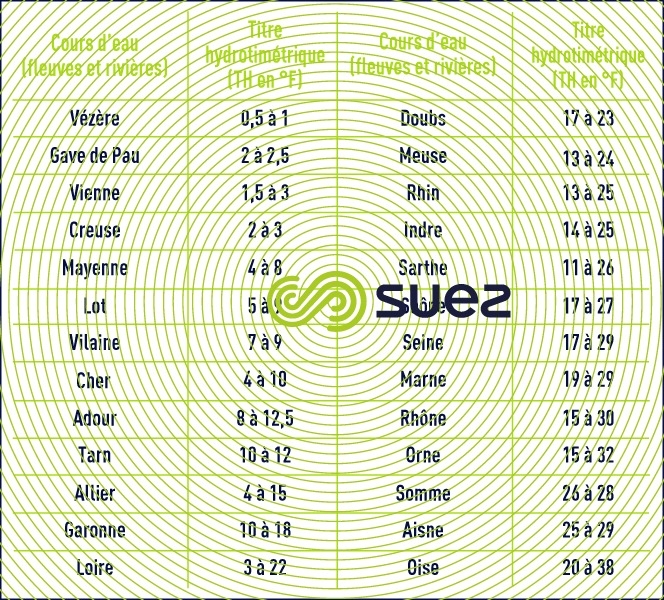
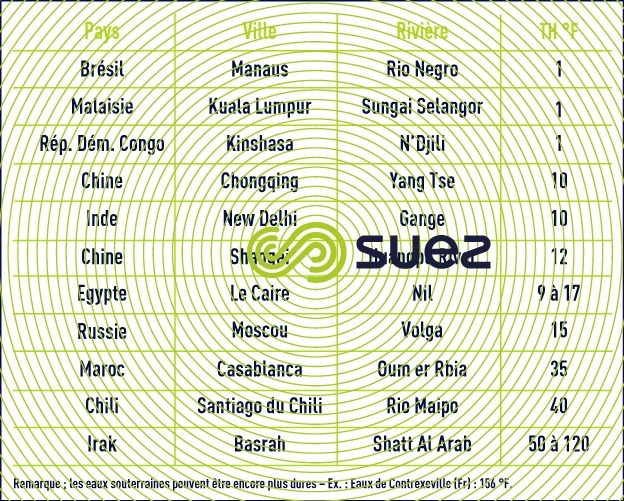
Conséquence de ce qui précède, la dureté des eaux, mesurée par leur titre TH (en °F), est très variable d’un endroit à l’autre (tableaux 43 et 44).
À titre d’exemple, une eau ayant un TH < 5 °F sera dite « douce », et l’on parle d’eau « dure » à partir d’un TH de 15 à 20 °F.




eaux agressives/eaux incrustantes
Avant même d’entrer dans une interprétation théorique des phénomènes de dissolution/précipitation du carbonate de calcium, on peut logiquement déduire que les eaux faiblement chargées en sels vont avoir conservé un potentiel de dissolution vis-à-vis des matériaux avec lesquels elles seront en contact (récipients, tuyaux…).
À l’inverse, les eaux riches en sels et surtout en sels alcalinoterreux auront la possibilité de laisser déposer les moins solubles de ceux-ci, elles auront tendance à produire des dépôts donnant lieu à la formation de cristaux à l’interface solide-liquide.
Le bicarbonate de calcium présente la particularité de n’exister qu’à l’état dissous ; s’il précipite, c’est à l’état de carbonate de calcium, très peu soluble, et sa présence dans l’eau ne peut être maintenue que s’il est équilibré par du CO2 libre :


La teneur en CO2 influant sur le pH, on peut en conclure que pour une minéralisation donnée (TCa et TAC fixes), il existe une valeur du pH qui correspond à l’équilibre entre cette eau et le carbonate de calcium : on appelle cette valeur le pH d’équilibre oupH de LangelieroupH de « saturation », d’où le nom de « pHS » (la teneur en CO2 correspondante s’appelle alors CO2 équilibrant, notion qui sera quantifiée plus loin).
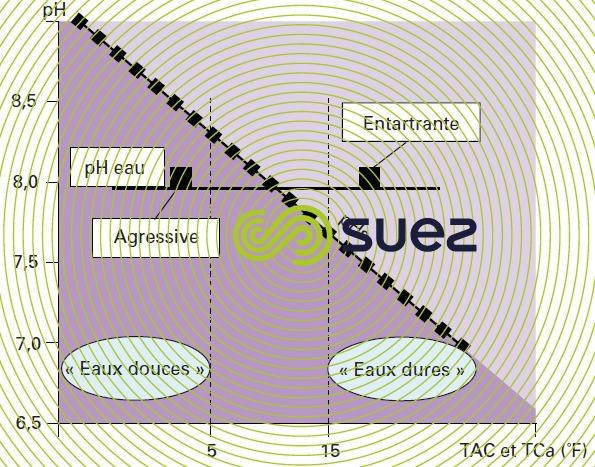
On peut donc « classer » les eaux en fonction de la valeur de leur pH vis-à-vis de ce pHS :
- si pH > pHS, les eaux auront tendance à déposer du CaCO3, elles sont dites entartrantes ;
- si pH < pHS, elles auront tendance à dissoudre du CaCO3, elles sont dites agressives.
Remarque : On verra ultérieurement que la valeur du pHS d’une eau augmente lorsque son TAC (donc sa minéralisation) diminue. Par ex. (figure 99) pour un pH systématiquement réglé à 8 (pour refoulement dans un réseau), une eau peu minéralisée aura un pHS plus élevé et sera donc encore agressive, tandis qu’une eau plus minéralisée aura un pHS plus faible et sera donc entartrante ; ceci explique une certaine « corrélation » entre eau douce et eau agressive, ou eau dure et eau incrustante, malgré des significations différentes.
Le potentiel de précipitation de carbonate de calcium est un paramètre intéressant pour quantifier ce qui peut entartrer ou ce qui peut dissoudre (tuyaux en béton), sachant que le CCPP est une concentration exprimée en CaCO3 (positif si l’eau est incrustante, ou négatif si l’eau est agressive).


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












