bases théoriques de l'échange gaz-liquide
Temps de lecture :Les lois principales régissant l’échange gaz/liquide sont :
- dans la phase liquide et à l’équilibre, la loi de Henry qui relie, pour une température donnée, la pression partielle d’un gaz p à sa fraction molaire x en phase liquide : p = Hx, H étant la constante de Henry. On trouve aux constantes caractéristiques des gaz, la constante de Henry des principaux gaz ;
- dans la phase gazeuse : la loi de Dalton et la loi des gaz parfaits.
Ainsi, pour un mélange gazeux occupant un volume V à la température T sous une pression P et constitué de m1, m2… mn quantités massiques de gaz de masses molaires respectives Ml, M2 Mn exerçant des pressions partielles p1, p2 pn, on peut écrire :

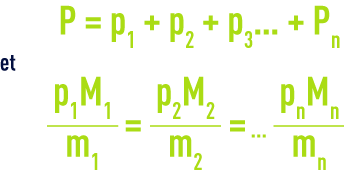
Pour le transfert : la théorie de Whitman et Lewis qui permet de quantifier le flux global N de composé transféré à travers la surface d’échange S en l’absence d’accumulation à l’interface (figure 108) :


CL et Cg sont les concentrations du gaz dans les phases liquide et gazeuse, seules accessibles à la mesure.
CiL, et Cig. sont les concentrations à l’interface, kL et kg étant des coefficients de transfert dans les phases liquide et gazeuse dépendant de l’interface et de l’état de turbulence.



Ces lois mettent en valeur les paramètres essentiels d’un transfert efficace :
- maintien d’un fort gradient de concentration entre phase liquide et gazeuse, ce gradient agissant à la façon d’une force motrice (driving force) ;
- création d’une interface gaz/liquide aussi importante que possible ;
- utilisation d’un fort état de turbulence dans chacune des 2 phases.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












