méthodes de détermination du pHs
Temps de lecture :les ions en présence
On distingue :
- les « ions constitutifs » : H+, ou mieux H3O+ car il s’agit d’un ion hydraté, et OH– ;
- les autres ions fondamentaux : Ca2+, HCO3–, CO32– ;
- les ions secondaires : Na+, K+, Mg2+, Fe2+… Cℓ–, SO42–, NO3–, SiO32–…
les équilibres et leurs constantes thermodynamiques
Parmi l’ensemble de ces ions, quatre équilibres majeurs régissent leurs concentrations réciproques :
- a) l’égalité des charges électriques positives et négatives (relation de neutralité électrique) :

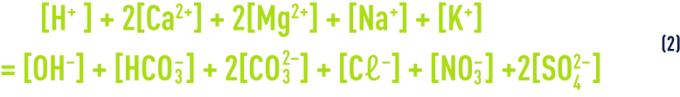
que l’on peut aussi écrire :


P et N représentant respectivement les concentrations en Mg, K et Na d’une part et en Cℓ, NO3 et SO4 d’autre part.
Remarque : Fe, Mn, SiO2… sont des éléments dits « mineurs » dont la concentration peut être considérée comme négligeable par rapport aux autres.
- b) l’ionisation de l’eau :

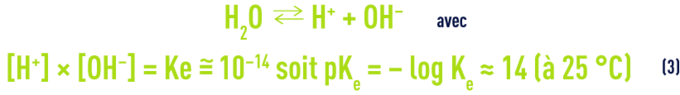
- c) La dissolution et la dissociation de l’acide carbonique :

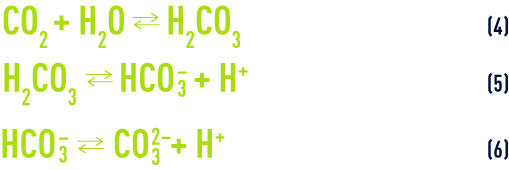
À une température de 25 °C et en l’absence d’autres sels dissous, la loi d’action de masse appliquée aux équilibres (5) et (6) (voir ionisation) nous donne :

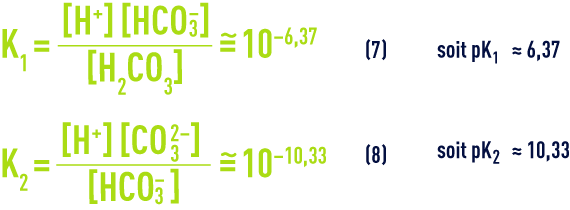
- d) L’équilibre de la dissolution/précipitation du carbonate de calcium :

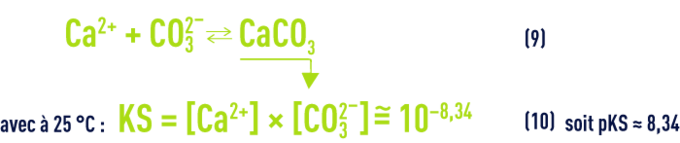
Remarques :
D’autres équilibres peuvent intervenir, qui mettent en jeu des acides faibles : c’est la cas de SiO2, de H2S ou des acides humiques ; nous les négligerons, car ils influent peu et représentent des cas particuliers.
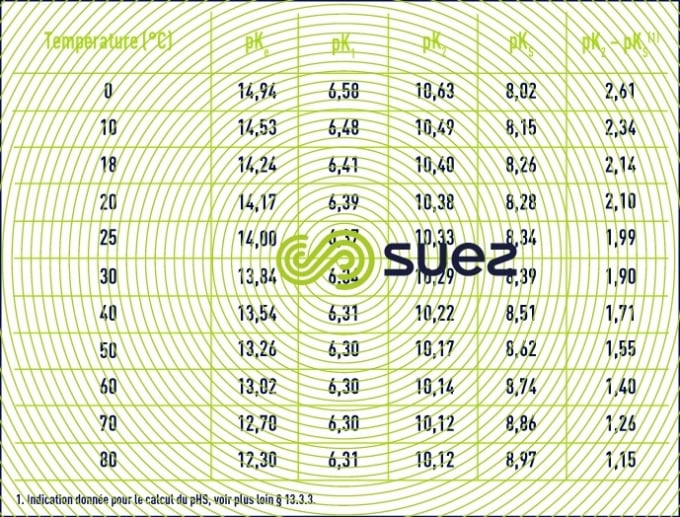
Les constantes thermodynamiques ci-dessus subissent des variations significatives en fonction de la température (tableau 45).


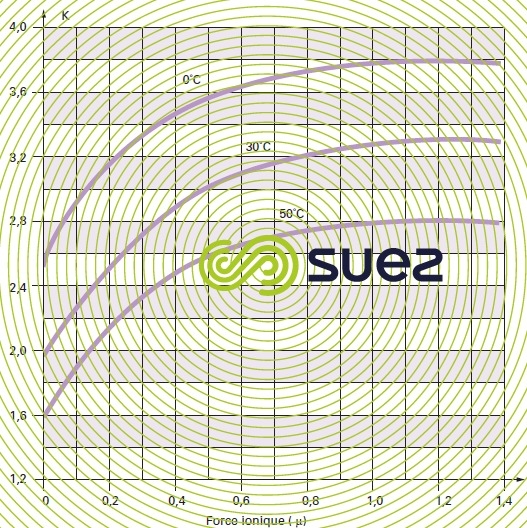
- Pour des raisons pratiques, les valeurs figurant dans le tableau 45 correspondent à des constantes apparentes (Debye & Hückel), basées sur les concentrations (déduites des analyses et exprimées en mol/L) des différents ions et non sur leurs activités ; d’autre part, elles dépendent aussi de la salinité de l’eau ; cette influence s’apprécie par une grandeur appelée force ionique, désignée par µ, exprimée en moles par litre et définie par la relation :pour apporter une correction de force ionique aux différents pK :

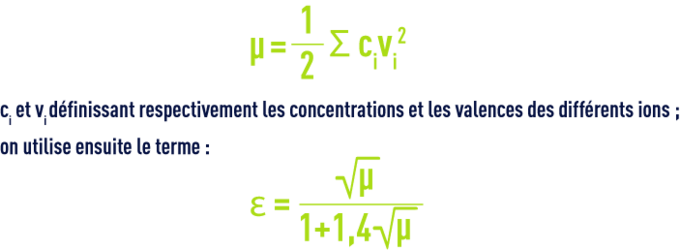

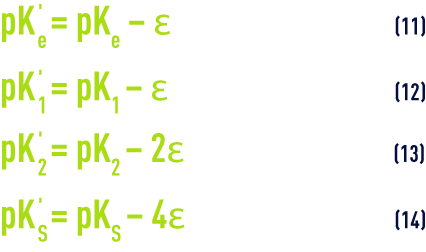
- Quelques valeurs approchées de Ɛ (si l’on ne dispose pas d’une balance ionique complète, on peut également déduire Ɛ de la résistivité) sont indiquées dans le tableau 46 :

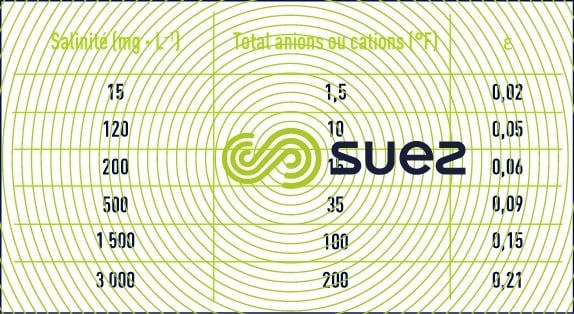

Tableau 46. Quelques exemples d’ordres de grandeur du terme ε - Ces équations nous montrent que le pH d’une eau dépend directement de ses teneurs relatives en CO2 libre d’une part, en ions HCO3– et CO32- (c’est-à-dire l’alcalinité mesurée par le TAC) d’autre part ; des équations (7) et (12), en particulier, on tire :

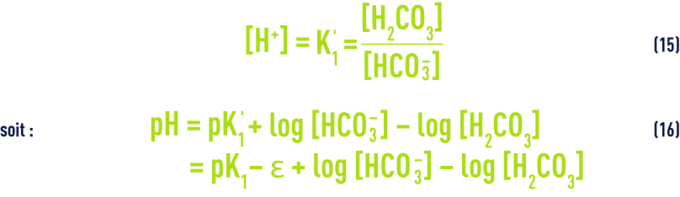
On a vu plus haut les valeurs de pK1 en fonction de la température et de e en fonction de la salinité ; d’autre part, dans les eaux dont le pH est inférieur à 8,4 (ce qui correspond à la majorité des eaux naturelles), on peut négliger la concentration en ions CO32– et estimer que le TAC représente la concentration des seuls ions HCO3– ; enfin, [H2CO3] correspond à la mesure de la totalité du CO2 libre, car on ne peut pas mesurer séparément l’acide carbonique non dissocié H2CO3 et le gaz carbonique CO2 dissous dans l’eau.
Il en résulte que dans toute eau, il existe une relation étroite entre le pH, le TAC et le CO2 libre ; après transposition des concentrations en mol · L–1 :

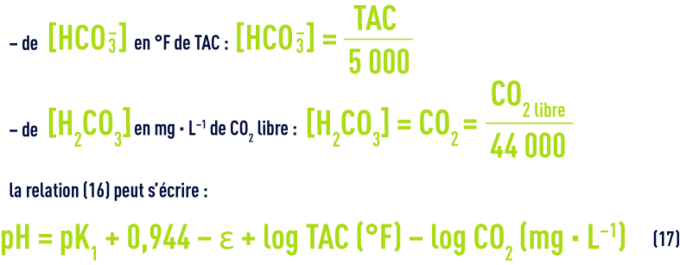
approche du pHS par le calcul
Quand une eau est à l’équilibre calcocarbonique (ni agressive, ni incrustante, voir objectifs des traitements), cela signifie qu’elle est saturée en CaCO3 et que les concentrations (en mol · L–1) des ions CO32– et Ca2+ satisfont au produit de solubilité (10), qui peut s’écrire aussi :

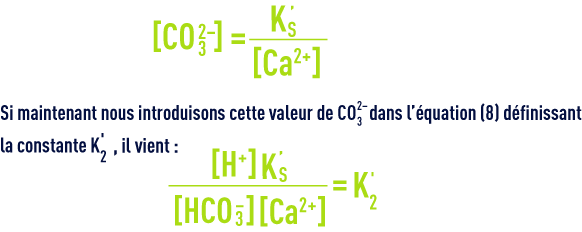
En écrivant encore différemment cette équation, on saura qu’une eau est en équilibre avec le calcaire si :

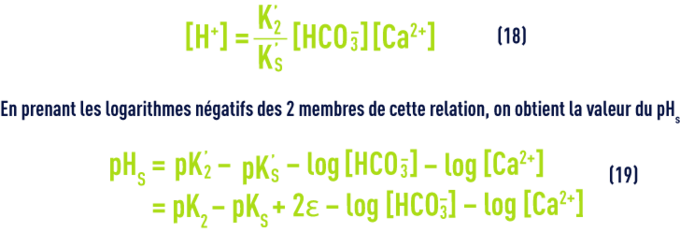
On trouvera directement les valeurs de pK2 – pKS (en fonction de la température) et de e (en fonction de la salinité) dans les tableaux 45 et 46 ci-avant. Comme e, le pHS croît avec la salinité et ceci devient important pour les eaux saumâtres (salinité > 1 g · L–1).
À partir du TAC et du TCa (°F), cette relation devient pour les eaux à pH < 8,4 environ :


Nous avons déjà vu que si pH < pHS, l’eau a tendance à dissoudre le calcaire (agressivité) ; la valeur trop basse du pH est due à un excès de gaz carbonique dissous, dont la fraction qui est susceptible de réagir avec le carbonate de calcium est appelée CO2 agressif. La concentration en CO2 qui correspondra exactement au pHS est appelée CO2 équilibrant (au sens de l’équilibre chimique (1) vu à la section l'équilibre calco-carbonique/Eaux agressives/Eaux incrustantes) ; la teneur totale en CO2libre dissous est donc, dans ce cas, égale à la somme : CO2 équilibrant + CO2 en excès (dont une partie est du CO2 agressif au calcaire, qui déplace l’équilibre (1) vers la gauche).
Au contraire, une eau dont pH > pHS est incrustante : elle présente un déficit en CO2 dissous, qu’elle tend à compenser en déplaçant l’équilibre (1) vers la droite avec précipitation de CaCO3.
approche du pHS par des méthodes graphiques
généralités
De nombreux auteurs ont développé leurs méthodes : Franquin et Marécaux, Tillmans, Hallopeau et Dubin, Legrand et Poirier sont parmi les plus connus.
L’objectif est toujours le même : définir un plan de représentation avec des axes liés à un paramètre (pH) ou à une somme de paramètres (TAC, CO2 total) et, sur ce plan, tracer le lieu représentatif des eaux à l’équilibre calcocarbonique : ce lieu dit « courbe d’équilibre », délimite le plan en deux parties, les eaux agressives (pH < pHS) et les eaux entartrantes (pH > pHS).
Pour mémoire c’est à Tillmans que l’on doit la notion de protection des métaux par une couche protectrice de carbonates de fer et de calcium (d’où le nom de couche de Tillmans).
le diagramme de Langelier
Langelier a introduit la notion de pH comparé au pHs, d’où la définition de l’indice de Langelier : ILou IS (Indice de Saturation) = pH – pHS ; donc : IS = 0 : eau à l’équilibre, IS < 0 : eau agressive, IS > 0 : eau incrustante.
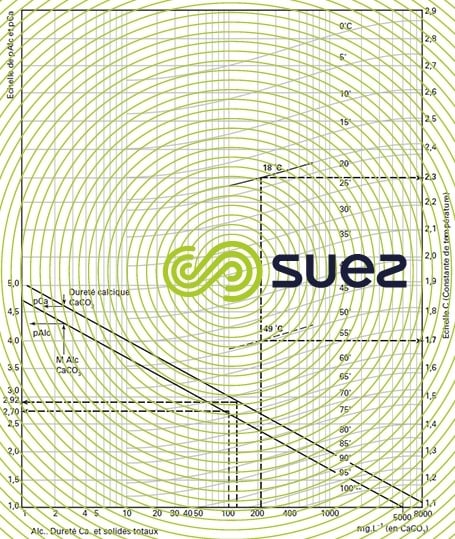
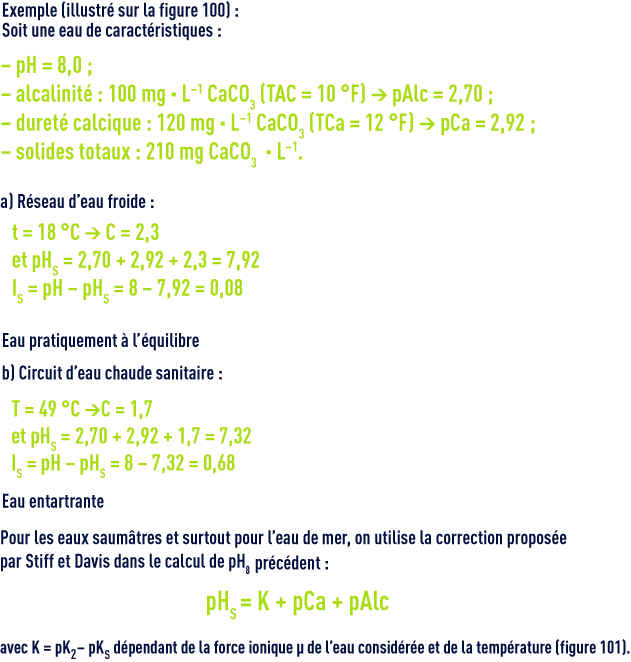
Pour la détermination de ce pHS, Langelier a établi un graphique faisant intervenir l’alcalinité et le calcium,exprimés en mg · L–1 de CaCO3, et la salinité totale (extrait sec en mg · L–1).
Le pHs se déduit du diagramme (figure 100) par la relation suivante :

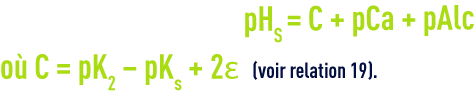
Ce diagramme tient compte de la température et de la salinité jusqu’à environ 3 g · L–1 mais ne permet pas le calcul des doses de réactifs de « neutralisation ».





méthode de Hallopeau et Dubin
Ces auteurs ont établi une méthode graphique permettant de caractériser quantitativement la teneur en CO2 libre d’une eau et sa fraction agressive au calcaire, de calculer les quantités de réactifs de neutralisation et de prévoir les caractéristiques de l’eau après correction pour ajuster le pH à la valeur de l’équilibre calcocarbonique.
En exprimant le pH d’équilibre en fonction des logarithmes de l’alcalinité (mesurée par le TAC et exprimée en mol · L–1) et de la dureté calcique (en mol · L–1), on a :

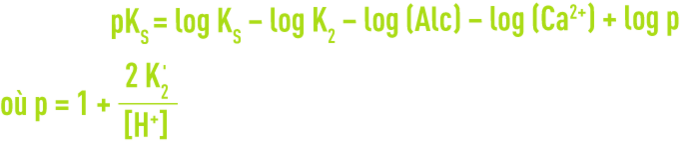
Dans ce graphique (figure 102), CO2 libre et pH d’équilibre sont alors représentés par deux familles de droites parallèles. Pour une eau donnée, le pHS est déterminé par l’intersection entre :
- la verticale tracée à partir du point représentatif M, défini par le TAC et le pH de l’eau ;
- et la parallèle à la droite de « saturation CaCO3 à 15 °C », tracée à partir du point représentatif de l’eau dans le diagramme auxiliaire de gauche, qui comporte les valeurs du rapport TAC/TCa en abscisses et de la température en ordonnées.



Si le point M se trouve déjà sur une telle droite, l’eau est à l’équilibre calcocarbonique; au-dessous, elle est agressive, au-dessus elle est incrustante.
Le graphique donne également le pHS correspondant à la précitation de Mg(OH)2 à 25 °C soit :


Connaissant le pH et l’alcalinité d’une eau, on peut aussi déterminer le CO2 libre et le CO2 équilibrant (sur l’échelle de droite, en suivant un chemin parallèle au réseau de droites obliques). Le graphique met en évidence les courbes de dissolution ou d’évasion physique du CO2 et les courbes de neutralisation par la chaux (ou la soude) ou par le calcaire (ou Na2CO3) : ces dernières sont obtenues en traçant, à partir du point représentatif de l’eau, une courbe parallèle à la courbe de base correspondante, telle qu’obtenue par translation parallèle à l’axe des abscisses.
La figure 103 donne l’exemple d’une eau dont le point représentatif M, défini par ses coordonnées (TAC, pH), est situé en zone agressive : pour qu’elle soit amenée à l’équilibre, 3 voies sont possibles :



- n° 1 : évasion de CO2 par aération ; le TAC et le calcium restent inchangés, le pH d’équilibre correspond alors au pHS de l’eau initiale (en fait rarement réalisable sauf pour les eaux à fort TAC où le CO2 équilibrant est suffisamment élevé) ;
- n° 2 : neutralisation par une base ; il y a augmentation du TAC et, si on emploie de la chaux, du calcium dans la même proportion ;
- n° 3 : neutralisation par un carbonate (CaCO3 ou Na2CO3) ; le TAC et éventuellement le calcium (dans le cas du CaCO3) augmentent d’une quantité environ 2 fois plus forte que dans le cas précédent.
On peut constater que d’une part, le pH d’équilibre est différent dans les 3 cas étudiés et que, d’autre part, il est d’autant plus faible que le TAC final est plus élevé.
Dans les cas n° 2 et 3, la différence entre TAC final et TAC initial permet de déterminer la quantité de réactif alcalin à mettre en œuvre après évaluation du déplacement de la droite d’équilibre lié à la variation du rapport alcalinité/calcium au cours de la neutralisation.
Bien qu’introduisant les notions de duretés calcique et totale, cette méthode ne tient pas compte de la salinité totale et ne concerne que les eaux faiblement à moyennement minéralisées.
méthode de Legrand et Poirier
Ces auteurs ont considéré le système de coordonnées (Ca2+) en abscisse et « CO2 total » en ordonnée (figure 104).


Ils justifient ce choix par les avantages qui en découlent : les échelles sont arithmétiques (en principe en millimoles · L–1), ce qui permet d’éviter le rejet des origines à l’infini ; les concentrations de tous les éléments fondamentaux y apparaissent immédiatement ; les déplacements du point figuratif de l’eau s’y effectuent pratiquement toujours suivant des droites ou suivant la courbe d’équilibre ; enfin, la pratique d’un traitement se traduit sur ce graphique soit par un déplacement du point figuratif, soit par une modification de la courbe d’équilibre, soit par les deux à la fois.
Si N et P représentent les sommes respectives des ions secondaires positifs et négatifs, et en posant

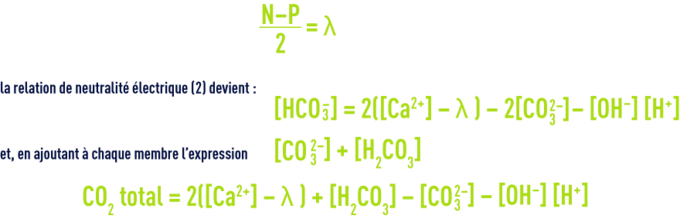
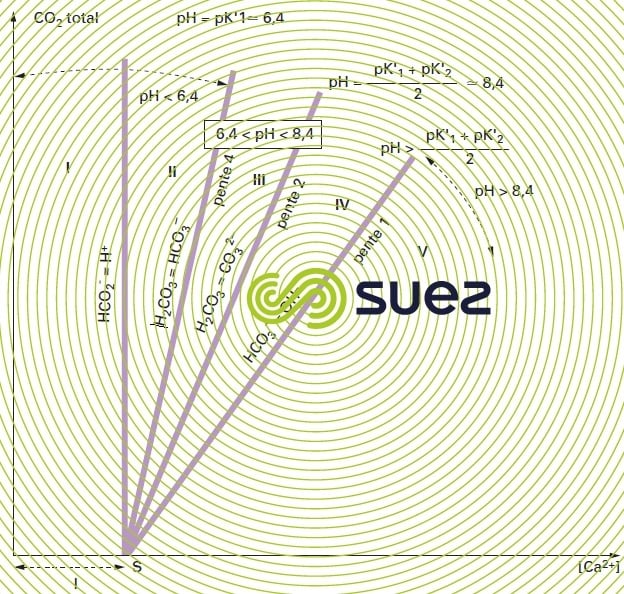
En adoptant les coordonnées exposées plus haut, on obtient un graphique dont le plan est divisé en régions limitées par les principaux cas particuliers (correspondant à la famille de courbes pH = constante, qui est une famille de droites concourant au point S d’abscisse l) ; la figure 104 montre quelles sont ces régions : on peut voir qu’en pratique, la quasi totalité des eaux naturelles (avant ou après traitement) est comprise dans la région III, c’est-à-dire entre la droite de pente 4 (qui correspond à pH = pK1' = environ 6,4 à 20 °C) et la droite de pente 2 qui correspond à :


La courbe sur laquelle figurent toutes les eaux à l’équilibre calcocarbonique, pour des valeurs données de la température et du paramètre l, est du type représenté sur la figure 105 ; cette figure donne en outre l’exemple du point figuratif M d’une eau donnée, agressive, vu sa position par rapport à la courbe d’équilibre et les renseignements que l’on peut en tirer vis-à-vis des caractéristiques de l’eau (en particulier la proportion de CO2 agressif dans la teneur totale en CO2 libre).



méthode degremont® : "calcograph"
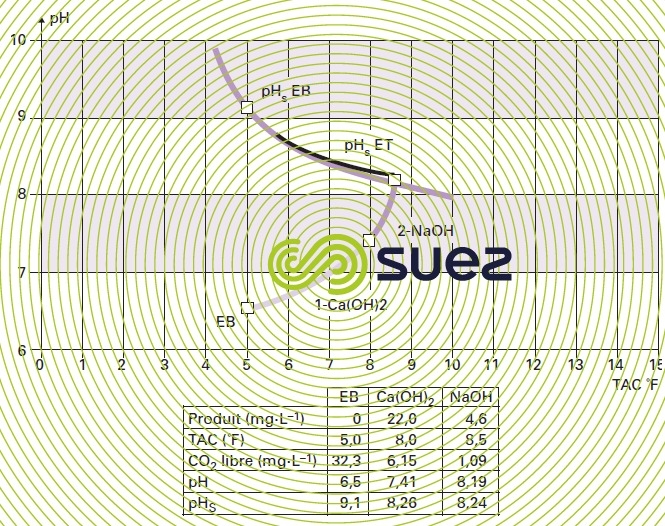
Cette méthode fait appel au concept de Hallopeau et Dubin dans lequel on représente les eaux sur un diagramme pH = f(TAC), mais avec des échelles linéaires.

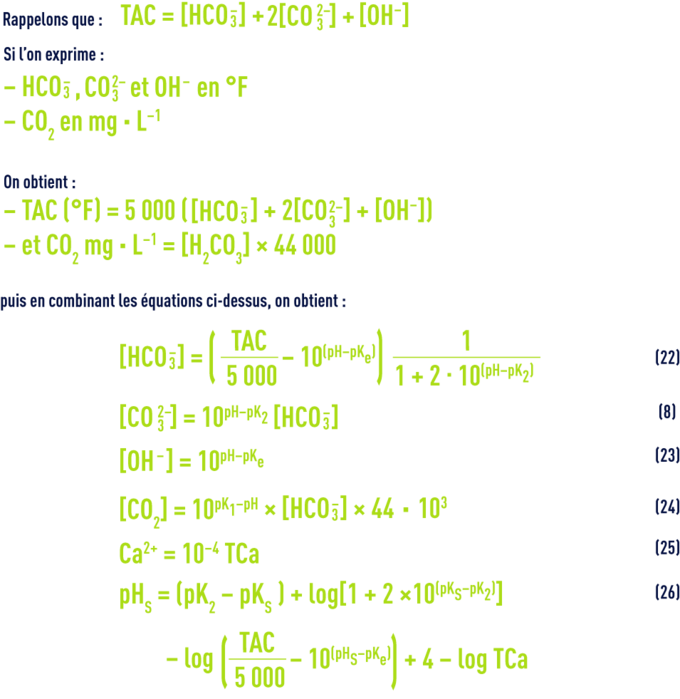
Le logiciel informatique calcule donc :
- le CO2 à partir du pH et du TAC, ou le pH à partir du CO2 et du TAC (relations 22 et 24) ;
- le pHS à partir du TAC et du TCa (relation 26).
Le programme tient compte des variations des différents pK en fonction de la température et de la concentration ionique de l’eau (tableau 45 et équations 11 à 14).
On peut donc repérer le point figuratif d’une eau (par son pH et son TAC) et tracer la courbe des eaux dont le pH est égal à pHS, pour des TAC variables : c’est la « courbe d’équilibre calcocarbonique » (ou pHSEB).
À chaque addition de réactif, le logiciel redéfinit les nouveaux paramètres et représente le nouveau point figuratif, le trajet suivi, ainsi que le nouveau pHS appelé pHSET, d’où le nom de Calcograph (figure 106).


possibilités de correction d’une eau agressive – Indices
Nous avons vu plus haut les définitions des diverses formes du CO2 : libre, en excès, agressif, équilibrant. Sachant qu’il existe 3 moyens de remise à l’équilibre d’une eau agressive (voir figure 103), la figure 107 et le tableau 47 donnent les 3 pHS finaux et donc 3 CO2 équilibrants différents (calculés par le programme et affichés en dernière ligne du tableau).

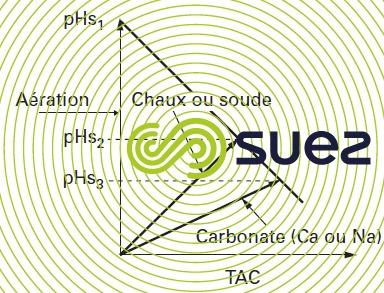




On en déduit différentes expressions du CO2 en excès :
- l’aération à TAC constant : 34,1 – 0,26 = 33,84 mg · L–1 de CO2 à stripper ;
- la neutralisation par la chaux : 34,1 – 1,3 = 32,80 mg · L–1 de CO2 à neutraliser ;
- la neutralisation par CaCO3 : 34,1 – 3,36 = 30,74 mg · L–1 de CO2 agressif vis-à-vis du CaCO3 ; par définition, le « test au marbre » est le moyen d’accéder expérimentalement au CO2 agressif vis-à-vis du calcaire : en France on l’exprime en « mg CO2 · L–1 », dans les pays anglo-saxons on le traduit en « mg · L–1 de CaCO3 solubilisable »).


indices
Il a souvent été tenté de caractériser les eaux, par rapport à l’équilibre calcocarbonique (avec un intérêt particulier pour les eaux agressives) et à leur comportement vis-à-vis des métaux ferreux, par différents indices dont les plus utilisés sont :
- indice de Langelier ou indice de saturation (voir réactifs et traitements utilisables) :
IL = IS = pH – pHS ;

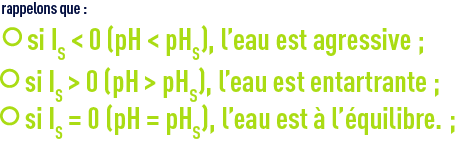
- indice de Larson, rapport entre les concentrations en sels d’acides forts et en ions hydrogénocarbonates (voir objectifs des traitements) ;
- indice de Ryznar défini par :


Cet indice est toujours positif. Suivant sa valeur, on a déterminé expérimentalement (à des températures comprises entre 0 et 60 °C) les tendances de l’eau selon l’échelle suivante :



La neutralisation de l’agressivité visera avant tout à annuler l’indice de Langelier s’il est négatif au départ ; l’indice de Larson indique une eau à tendance d’autant plus corrosive qu’il est élevé et peut inciter à prendre des mesures particulières (réglage à IS > 0, reminéralisation…) ; l’examen de l’indice de Ryznar, doit être réservé exclusivement à l'étude des circuits industriels, et tout particulièrement les circuits de refroidissement. En effet, l'indice de Ryznar donne des conclusions qui différent de celles de Langelier. Pour exemple :


L'explication réside dans le fait que les conditionneurs d'eau considèrent à juste titre que les effets d'une eau entartrante peuvent être annuler par un traitement chimique curatif, contrairement aux effets d'une eau agressive. Les conditionneurs d'eau ont donc tendance à déplacer la valeur du pH d'équilibre entre eau agressive et entartrante, et calculer les dosages préventifs en conséquence (voir corrosion des métaux et bétons et traitement et conditionnement des eaux industrielles), ainsi que d’autres paramètres (tels que O2 dissous, minéralisation, Fe-Mn, bactéries de la corrosion…) indiquera si, par ailleurs, un traitement complémentaire est nécessaire.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












